甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)已知:CO(g)+1/2O2(g)=CO2(g) △H=—283 kJ·mol—1
2H2(g)+O2(g)=2H2O(l) △H=—285.8 kJ·mol—1
CH3OH(l)+3/2O2(g)=CO2(g) +2H2O(l) △H=—725kJ·mol—1
则反应CO(g)+2H2(g)=CH3OH(l)的△H=_______。
(2)工业上合成甲醇一般采用下列反应:CO(g)+2H2(g) CH3OH(g) △H="—a" kJ/mol(a>0),H2的平衡转化率与温度、压强的关系如下图所示。
CH3OH(g) △H="—a" kJ/mol(a>0),H2的平衡转化率与温度、压强的关系如下图所示。

压强:P1 P2(填“>”、“=”或“<”)。
(3)在容积固定的密闭容器中发生CO(g)+2H2(g) CH3OH(g) △H="—a" kJ/mol(a>0),各物质的浓度如下表:
CH3OH(g) △H="—a" kJ/mol(a>0),各物质的浓度如下表:
| 浓度mol/L 时间/min |
c(CO) |
c(H2) |
c(CH3OH) |
| 0 |
0.8 |
1.6 |
0 |
| 2 |
0.6 |
1.2 |
0.2 |
| 4 |
0.3 |
0.6 |
0.5 |
| 6 |
0.3 |
0.6 |
0.5 |
①反应从2 min到4 min之间,H2的反应速率为 。
②反应达到平衡时CO的转化率为 。
③反应在第2 min时改变了反应条件,改变的条件可能是 (填序号)。
A.使用催化剂 B.降低温度 C.增加H2的浓度
(4)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,实验室用如图装置模拟该过程,其原理是:通电后,Co2+被氧化成Co3+,然后以Co3+做氧化剂把甲醇氧化成CO2而除去(Co3+的还原产物是CO2+)。

①写出阳极电极反应式_____________________________________;
②写出除去甲醇的离子方程式_______________________________。
)设反应①Fe(s)+CO2(g) FeO(s)+CO(g)△H = Q1的平衡常数为K1,
FeO(s)+CO(g)△H = Q1的平衡常数为K1,
反应②Fe(s)+H2O(g) FeO(s)+H2(g)△H = Q2的平衡常数为K 2,在不同温度下,K1、K2的值如下:
FeO(s)+H2(g)△H = Q2的平衡常数为K 2,在不同温度下,K1、K2的值如下:
| 温度( T ) |
K1 |
K2 |
| 973 |
1.47 |
2.38 |
| 1173 |
2.15 |
1.67 |
(1)从上表可推断,反应①是_______(填“放”或“吸”)热反应;K2的数学表达式为。
(2)现有反应③H2(g)+CO2(g) CO(g)+H2O(g)△H = Q3 ①根据反应①与②推导出K1、K2、K3的关系式K3=_____________;可推断反应③是________(填“放”或“吸”)热反应。要使反应③在一定条件下建立的平衡右移,可采取的措施有__________。
CO(g)+H2O(g)△H = Q3 ①根据反应①与②推导出K1、K2、K3的关系式K3=_____________;可推断反应③是________(填“放”或“吸”)热反应。要使反应③在一定条件下建立的平衡右移,可采取的措施有__________。
| A.缩小容器体积 | B.降低温度 | C.使用合适的催化剂 |
| D.设法减少CO的量E.升高温度 |
②根据反应①与②推导出Q1、Q2、Q3的关系式Q3 =_____________。
有一包白色固体,可能含有NaCl、Na2SO4、CaCl2、CuSO4、Na2CO3 和CaCO3 ,将固体放入水中,经搅拌后为无色溶液,在溶液里加入BaCl2 溶液,产生白色沉淀,再加入盐酸,沉淀全部消失并有气体放出,由此推断:
(1)原固体肯定有______________。
(2)原固体肯定不存在。
(3)__________不能确定存在与否,要确定其存在,应进行的实验是___。
已知X、Y、Z、W四种元素分别是元素周期表中三个短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y的氢化物分子中有3个共价键。Z原子最外层电子数是次外层电子数的3倍,试推断:
(1)X、Z二种元素的元素符号:X_________、Z__________。
(2)由以上元素中两两形成的化合物中:溶于水显碱性的气态氢化物的结构式为:,它的共价键属于(填:极性、非极性)键;含有离子键和非极性共价键的化合物的电子式为。
(3)由X、Y、Z所形成的常见离子化合物是___________,该化合物与W的最高价氧化物的水化物的浓溶液加热时反应的离子方程式为:_________________________ ;
X与W形成的化合物与水反应时,水作的是(填:氧化剂、还原剂)。
已知A、B、C、D和E 5种分子所含原子数目依次为1、2、3、4和6,且都含有18个电子。又知B、C和D是由两种元素的原子组成。请回答:
(1)组成A分子的原子的核外电子排布式是;
(2)B和C的分子式相对稳定的是;
(3)若向D的稀溶液中加入少量二氧化锰,有无色气体生成。该反应的化学方程式为。
(4) 若将1mol E在氧气中完全燃烧,只生成1mol CO2和2molH2O,则E的分子式是。
氯化铁是常见的水处理剂,无水FeCl3的熔点为555K、沸点为588K。工业上制备无水FeCl3的一种工艺如下: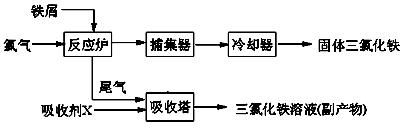
(1)试写出吸收塔中反应的离子方程式:____________________________。
(2)已知六水合氯化铁在水中的溶解度如下:
| 温度/℃ |
0 |
10 |
20 |
30 |
50 |
80 |
100 |
| 溶解度(g/100gH20) |
74.4 |
81.9 |
91.8 |
106.8 |
315.1 |
525.8 |
535.7 |
从FeCl3溶液中获得FeCl3·6H2O的方法是:。
(3)室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为2.7时,Fe3+开始沉淀;当溶液pH为4时,c(Fe3+)= mol/L(已知:Ksp[Fe(OH)3]= 1.1×10-36)。
(4)FeCl3的质量分数通常可用碘量法测定:称取m克无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容;取出10mL,加入稍过量的KI溶液,充分反应后,滴入某一指示剂并用c mol/L Na2S2O3溶液滴定用去V mL。
( 已知:2Fe3++2I-= I2+2Fe2+I2+2S2O32-=2I- +S4O62-)
①滴定终点的现象是:____________________________。
②样品中氯化铁的质量分数为__________________。