氯化铁是常见的水处理剂,无水FeCl3的熔点为555K、沸点为588K。工业上制备无水FeCl3的一种工艺如下: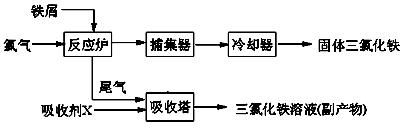
(1)试写出吸收塔中反应的离子方程式:____________________________。
(2)已知六水合氯化铁在水中的溶解度如下:
| 温度/℃ |
0 |
10 |
20 |
30 |
50 |
80 |
100 |
| 溶解度(g/100gH20) |
74.4 |
81.9 |
91.8 |
106.8 |
315.1 |
525.8 |
535.7 |
从FeCl3溶液中获得FeCl3·6H2O的方法是: 。
(3)室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为2.7时,Fe3+开始沉淀;当溶液pH为4时,c(Fe3+)= mol/L(已知:Ksp[Fe(OH)3]= 1.1×10-36)。
(4)FeCl3的质量分数通常可用碘量法测定:称取m克无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容;取出10mL,加入稍过量的KI溶液,充分反应后,滴入某一指示剂并用c mol/L Na2S2O3溶液滴定用去V mL。
( 已知:2Fe3++2I-= I2+2Fe2+ I2+2S2O32-=2I- +S4O62-)
①滴定终点的现象是:____________________________。
②样品中氯化铁的质量分数为__________________。
洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为
;
(2)漂白粉的有效成分是(填化学式);
(3)漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为;
(4分)氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用。请你根据所学知识回答下列问题:
把氯气通入紫色石蕊溶液中,可以观察到的现象是:;
请你解释其中的原因
等物质的量的CO和CO2中所含O原子个数之比,二者的质量之比,在同温同压下的体积之比。
一块金属钠露置在空气中,发生:银白色→变暗→变白→出现液滴→白色固体一系列的变化,请分别写出如下方程式:
变暗:
变白:
出现液滴:
已知乳酸的结构简式为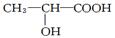 。试回答:
。试回答:
(1)乳酸分子中含有和两种官能团。
(2)乳酸跟氢氧化钠溶液反应的化学方程式:
(3)乳酸跟足量的金属钠反应的化学方程式:
(4)乳酸跟乙醇发生酯化反应生成的酯的结构简式为:
(5)相等的乳酸分别和足量的钠和碳酸氢钠反应生成气体的物质的量之比为