有机物A的化学式为C6H8O4Cl2,与有机物B、C、D、E的变化关系如下图:

1molA经水解生成2molB和1molC,根据上述变化关系填空:
(1)写出物质的结构简式:A 、 B 、 C 、D 、 E 。
(2)写出E转变为B的化学方程式: 。
常见的短周期元素A、B、C、D、E的原字序数穰沃增夫。常温下,A、C可形成A2C2和A2C两种液态化合物,B原子最外层电子数是次外层电子数的2倍,D原子电子层数与最外层电予数相等,E与C同主族。
(1)上述五种元素中,非金属性最强的是(填写元素名称)。
(2)元素D形成的简单离子的原子结构示意图为。
(3)A的单质与C的单质在强酸性条件下构成燃料电池,其正极反应式为。
(4)上述五种元素,由其中三种元素组成的易溶于水的物质中,能促进水电离的物质是:
(写出一种物质的化学式,下同),能抑制水电离的物质是:。
(5)常温常压时,2.8gBC气体在3.2gC2气体中完全燃烧,生成BC2气体时放出28.3kJ的热量,则表示BC燃烧的热化学方程式为。
J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如下表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的元素。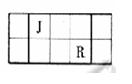
(1)元素T在周期表中位于第____ _族。
(2)J和氢组成的化合物分子有4个原子,其结构简式为 ___ _ __。
(3)M和R形成的一种化合物能使酸性高锰酸钾溶液褪色,该反应的离子方
程式为____。
(4)在微电子工业中,L的最简单气态氢化物的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为:
_____ _。
(5)写出三种仅由上述五种元素中的一种或两种元素形成的漂白剂的化学式:
有A、B、C、D、E五种短周期元素,其原子半径依次增大,B、C同主族,B有两种同素异形体,其中一种可以做漂白剂。C、D、E的最高价氧化物的水化物两两之间均能发生反应。
(1)A、B、C的气态氢化物中最稳定的是:。(填化学式)
(2)A、B、C的气态氢化物中B的氢化物沸点最高,原因是:
。
(3)B的另一种氢化物能与C的一种含氧酸钠盐的水溶液发生氧化还原反应。写出反应的化学方程式:
。
(4)画出E的原子结构示意图:。
(5)等物质的量的D、E投入水中充分反应后所得溶液呈碱性,原因是:
。(写离子方程式)
现有五种离子化合物 A、B、C、D 和 E,组成它们的离子有:
| 阳离子 |
K+Ag + Ba 2+ A13+Fe3+ |
| 阴离子 |
OH - C1 - SO4 2-NO3- CO32- |
为鉴别它们,分别完成以下实验,其结果是:
a. B 和 E 的水溶液均呈碱性。
b. A 溶于水后,与上述某阳离子反应生成的白色沉淀X,X既不溶于氨水也不溶于硝酸,且 A 溶液与过量氨水反应生成白色沉淀Y;
c. C 溶液与适量氨水反应生成无色溶液可与葡萄糖溶液发生银镜反应。
d. E 溶于水后,与上述某阴离子反应可生成 X;
e. A溶液与适量 E溶液反应生成白色沉淀,再加入过量 E溶液,沉淀量减少,但不消失。 请根据上述实验结果,填空:
(1)写出化合物的化学式:A,B,C。
⑵ 写出D与氨水反应的化学方程式:
⑶写出实验e中“A溶液与适量 E溶液反应生成沉淀”后“再加入过量 E溶液,
沉淀量减少”的离子方程式:。
J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如下表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的元素。
(1)元素T在周期表中位于第____ _族。
(2)J和氢组成的化合物分子有4个原子,其结构简式为 ___ _ __。
(3)M和R形成的一种化合物能使酸性高锰酸钾溶液褪色,该反应的离子方
程式为____。
(4)在微电子工业中,L的最简单气态氢化物的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为:
_____ _。
(5)写出三种仅由上述五种元素中的一种或两种元素形成的漂白剂的化学式: