脱水偶联反应是一种新型的直接烷基化反应,例如: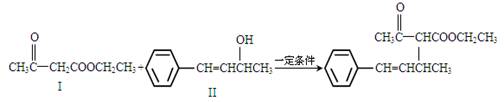
(1)化合物I的分子式为_____,1mol该物质完全燃烧最少需要消耗_____molO2。
(2)化合物II可使____溶液(限写一种)褪色;化合物III(分子式为C10H11C1)可与NaOH水溶液共热生成化合物II,相应的化学方程式为______。
(3)化合物III与NaOH乙醇溶液共热生成化合物IV,IV的核磁共振氢谱除苯环峰外还有四组峰,峰面积之比为为1∶1∶1∶2,IV的结构简式为_______。
(4)由CH3COOCH2CH3可合成化合物I。化合物V是CH3COOCH2CH3的一种无支链同分异构体,碳链两端呈对称结构,且在Cu催化下与过量O2反应生成能发生银镜反应的化合物VI。V的结构简式为______,VI的结构简式为______。
(5)一定条件下,  与
与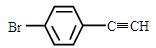 也可以发生类似反应①的反应,有机产物的结构简式为_____。
也可以发生类似反应①的反应,有机产物的结构简式为_____。
回答下列问题:
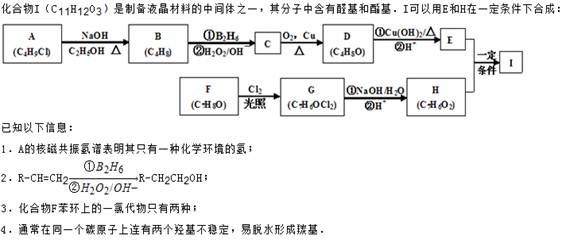
(1)A的化学名称为_________。
(2)D的结构简式为_________。
(3)E的分子式为。
(4)F生成G的化学方程式为________,该反应类型为__________。
(5)I的结构简式为___________。
(6)I的同系物J比I相对分子质量小14,J的同分异构体中能同时满足如下条件:
①苯环上只有两个取代基,②既能发生银镜反应,又能和饱和NaHCO3溶液反应放出CO2,共有______种(不考虑立体异构)。J的一个同分异构体发生银镜反应并酸化后核磁共振氢谱为三组峰,且峰面积比为2:2:1,写出J的这种同分异构体的结构简式。
草酸(乙二酸)可作还原剂和沉淀剂,用于金属除锈、织物漂白和稀土生产。一种制备草酸(含2个结晶水)的工艺流程如下: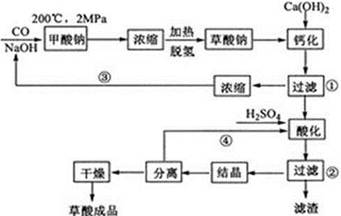
回答下列问题:
(1)CO和NaOH在一定条件下合成甲酸钠、甲酸钠加热脱氢的化学反应方程式分别为。
(2)该制备工艺中有两次过滤操作,过滤操作①的滤液是,滤渣是;过滤操作②的滤液是和,滤渣是。
(3)工艺过程中③和④的目的是。
(4)有人建议甲酸钠脱氢后直接用硫酸酸化制备草酸。该方案的缺点是产品不纯,其中含有的杂质主要是。
(5)结晶水合草酸成品的纯度用高锰酸钾法测定。称量草酸成品0.250g溶于水中,用0.0500 mol/L的酸性KMnO4溶液滴定,至粉红色不消褪,消耗KMnO4溶液15.00mL,反应的离子方程式为;列式计算该成品的纯度。
硅是重要的半导体材料,构成了现代电子工业的基础。回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号,该能层具有的原子轨道数为、电子数为。
(2)硅主要以硅酸盐、等化合物的形式存在于地壳中。
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以相结合,其晶胞中共有8个原子,其中在面心位置贡献个原子。
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备。工业上采用Mg2Si和NH4CI在液氨介质中反应制得SiH4,该反应的化学方程式为。
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
| 化学键 |
C-C |
C-H |
C-O |
Si-Si |
Si-H |
Si-O |
| 键能(KJ/mol) |
356 |
413 |
336 |
226 |
318 |
452 |
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是。
②SiH4的稳定性小于CH4,更易生成氧化物,原因是。
(6)在硅酸盐中,SiO44-四面体(如下图a)通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图b为一种无限长单链结构的多硅酸根;其中Si原子的杂化形式为。Si与O的原子数之比为化学式为。
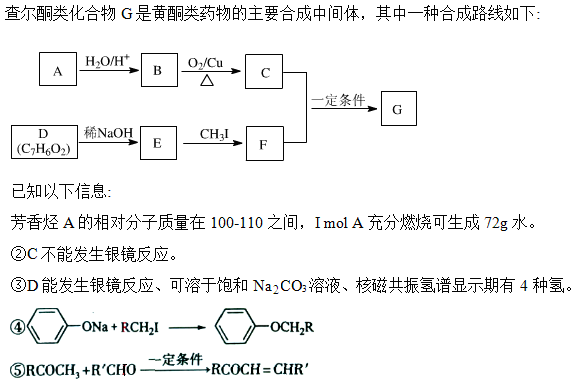
回答下列问题:
(1)A的化学名称为____________。
(2)由B生成C的化学方程式为____________________。
(3)E的分子式为________________,由E生成F的反应类型为________。
(4)G的结构简式为____________________。
(5)D的芳香同分异构体H既能发生银镜反应,又能与FeCl3溶液发生显色反应的共有_______种,其中核磁共振氢谱为5组峰,且峰面积为2:2:2:1:1的为________________(写结构简式)。
短周期元素A、B、C、D、E原子序数依次增大。A是周期表中原子半径最小的元素,B是形成化合物种类最多的元素,C是自然界含量最多的元素,D是同周期中金属性最强的元素,E的负一价离子与C的某种氢化物W分子含有相同的电子数。
(1)A、C、D形成的化合物中含有的化学键类型为;W的电子式 。
(2)已知:①2E → E-E;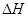 =-a kJ·mol-1② 2A → A-A;
=-a kJ·mol-1② 2A → A-A;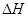 =-b kJ·mol-1
=-b kJ·mol-1
③E+A → A-E;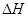 =-c kJ·mol-1
=-c kJ·mol-1
写出298K时,A2与E2反应的热化学方程式。
(3)在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2A2(g)+BC(g) X(g);
X(g);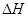 =-a KJ·mol-1(a>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
=-a KJ·mol-1(a>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
| 实验 |
甲 |
乙 |
丙 |
| 初始投料 |
2 mol A2、1 mol BC |
1 mol X |
4 mol A2、2 mol BC |
| 平衡时n(X) |
0.5mol |
n2 |
n3 |
| 反应的能量变化 |
放出Q1kJ |
吸收Q2kJ |
放出Q3kJ |
| 体系的压强 |
P1 |
P2 |
P3 |
| 反应物的转化率 |
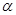 1 1 |
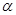 2 2 |
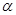 3 3 |
①在该温度下,假设甲容器从反应开始到平衡所需时间为4 min,则A2的平均反应速率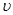 ( A2)为。
( A2)为。
②该温度下此反应的平衡常数K的值为。
③下列现象能说明甲容器中的反应已经达到平衡状态的有 (填序号)。
A.内A2、BC、X的物质的量之比为2:1:1
B.内气体的密度保持恒定
C.内A2气体的体积分数保持恒定
D.2 V正(A2)=V逆(BC)
④三个容器中的反应分别达平衡时各组数据关系正确的是(填序号)。
A.α1+α2=1 B.Q1+Q2=a C.α3<α1
D.P3<2P1=2P2 E.n2<n3<1.0mol F.Q3=2Q1
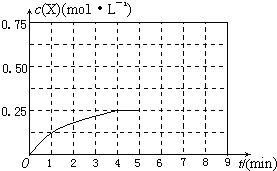
(4)在其他条件不变的情况下,将甲容器的体系体积压缩到1L,若在第8min达到新的平衡时A2的总转化率为75%,请在上图中画出第5min 到新平衡时X的物质的量浓度的变化曲线。