图中①~⑩分别代表有关反应中的一种物质,它们均是中学化学中常见物质。已知①~③和⑥~⑩中分别含有同一种元素。
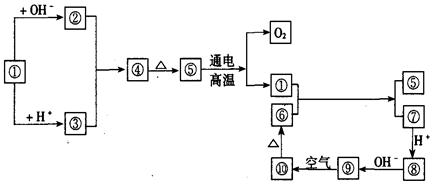
(1)分别写出①、④、⑧的化学式或离子符号:
①_________,④_________,⑧_________。
(2)写出下列反应方程式,是离子反应的写出离子方程式:
|
①+OH—→________________________________
|
⑤-→________________________________
①+⑥—→________________________________短周期元素A、B、C、D、E在元素周期表中的位置如下图所示,B是形成化合物种类最多的元素。
请回答下列问题:
(1)描述D在元素周期表中的位置:_____________________
(2)比较A、C、D元素简单离子半径的大小:______>______>______(填微粒符号)
(3)E的氢化物与其最高价氧化物的水化物的钾盐共热能发生反应,生成一种气体单质,反应的化学反应方程式为_______________________________________________.
(4)F与D同主族且相邻,请说出D的氢化物比F的氢化物稳定的根本原因:______________;
用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种具有较强的氧化性的阳离子,试写出阳离子的电子式:________,写出该阳离子与F氢化物的水溶液反应的离子方程式:__________________________________________________________。
(5)在Fe和Cu 的混合物中加入一定量的C的最高价氧化物的水化物稀溶液,充分反应后剩余金属m1g,再向其中加入一定量的稀硫酸,充分反应后,剩余金属m2g。下列说法正确的是()
A.加入稀硫酸前,加入稀硫酸后的溶液中肯定都有Cu2+
B.加入稀硫酸前,加入稀硫酸后的溶液中肯定都有Fe2+
C.m1一定大于m2
D.剩余固体m1g中一定有单质铜,剩余固体m2g中一定没有单质铜
甲、乙两组同学分别对铜、铁与硝酸的反应进行探究,请你参与并完成对有关问题的解答。
(1)甲组同学采用如图所示装置验证铜与硝酸的反应。已知仪器a中盛有足量一定浓度的硝酸溶液,试管b中盛有3.2 g铜。
①请写出铜与稀硝酸反应的离子反应方程式。
②在铜与硝酸的反应中,硝酸所表现出的化学性质主要有。
③仪器c中收集的气体主要是。(填分子式)
④待试管b中反应进行完全,如果向b中液体里加入足量氢氧化钠溶液,可生成沉淀的质量是g。
(2)乙组同学对铁与稀硝酸的反应进行探究。他们用a mol Fe和含有b mol HNO3的稀硝酸进行实验,若两种物质恰好反应都无剩余,且HNO3只被还原成NO,反应结束后溶液中含有Fe3+和Fe2+。则
①反应结束后的溶液中NO3-的物质的量的取值范围是。(用含a的代数式等表示)
②若反应结束后的溶液中Fe3+、Fe2+的物质的量之比n(Fe3+)∶n(Fe2+)为3∶1,则b/a的值为。
铝土矿(主要成分为Al2O3,还有少量杂质)是提取氧化铝的原料。提取氧化铝的工艺流程如下:
(1)请用离子方程式表示以上工艺流程中第①步反应:______________。
(2)写出以上工艺流程中第③步反应的化学方程式:_________________。
(3)金属铝与氧化铁混合在高温下,会发生剧烈的反应。该反应的化学方程式_____________。请举一例该反应的用途________________。
(4)电解熔融氧化铝制取金属铝,若有0.9mol电子发生转移.理论上能得到金属铝的质量是________________。
有机物X含有碳、氢、氧三种元素。
(1)探究X与钠反应产生气体的成分。
①X与钠反应产生的气体具有可燃性。将气体点燃,把一干燥的小烧杯罩在火焰上,片刻在烧杯壁上出现液滴,迅速倒转烧杯,向烧杯中加入少量澄清石灰水,未见浑浊。则X与钠反应产生的气体为________。
②根据苯、乙烷等碳氢化合物不能与钠反应产生上述气体这一事实,可得出X分子里有不同于烃分子里的氢原子存在。即有机物X除含有碳氢键之外,还有的化学键是________键。
(2)工业上, X可由乙烯与水反应制得,则X的分子式是________。
X分子含有的官能团的名称是________。写出X发生催化氧化反应的化学方程式______________。
X能被酸性高锰酸钾或重铬酸钾氧化为生活中的另一种重要的有机化合物Y,X与Y发生反应的化学方程式是________________。为了提高该反应的反应速率,可采取的措施是_______________。可用某溶液除去产品中混有的杂质,写出除杂过程发生反应的化学反应方程式______________________。
从能量的变化和反应的快慢等角度研究反应: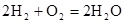 。
。
(1)为了加快正反应速率,可以采取的措施有________(填序号,下同)。
| A.使用催化剂 | B.适当提高氧气的浓度 |
| C.适当提高反应的温度 | D.适当降低反应的温度 |
(2)已知该反应为放热反应,下图能正确表示该反应中能量变化的是________。
(3)从断键和成键的角度分析上述反应中能量的变化。
【资料】①键能:拆开1mol化学键需要吸收的能量,或是形成1mol化学键所放出的能量称为键能。
②化学键的键能:
| 化学键 |
H—H |
O=O |
H—O |
键能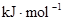 |
436 |
496 |
463 |
请填写下表:
| 化学键 |
填“吸收热量” 或“放出热量” |
能量变化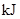 |
|
| 拆开化学键 |
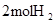 中的化学键 中的化学键 |
_______________ |
_______________ |
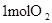 中的化学键 中的化学键 |
|||
| 形成化学键 |
 键 键 |
_______________ |
_______________ |
| 总能量变化 |
_______________ |
_______________ |
(4)氢氧燃料电池的总反应方程式为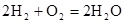 。其中,氢气在________(填“正”或“负”)极发生________反应(填“氧化”或“还原”)。电路中每转移0.2mol电子,标准状况下消耗H2的体积是________L。
。其中,氢气在________(填“正”或“负”)极发生________反应(填“氧化”或“还原”)。电路中每转移0.2mol电子,标准状况下消耗H2的体积是________L。