氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:
NO3-+4H++3e-=NO+2H2O ; KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式: 。
(2)反应中硝酸体现了 、 性质。
(3)反应中若产生0.2mol气体,则转移电子的物质的量是 mol。
(4)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是:
。
(5)KMnO4在酸性溶液中发生还原反应的反应式: ______ 。
某烃类化合物A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振氢谱表明分子中只有一种类型的氢。
(1)A的结构简式为;
(2)A中的碳原子是否都处于同一平面?(填“是”或“不是”);
(3)已知A、B、C有如下转化关系: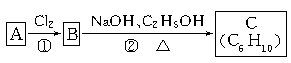
则反应②的化学方程式为;C的化学名称是。
(1)下列各化合物中,属于同系物的是,
属于同分异构体的是 填入编号)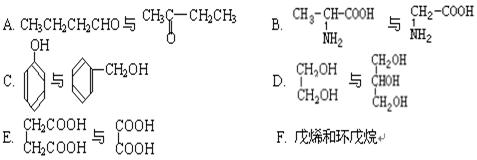
(2)系统命名法命名下列物质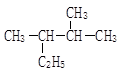
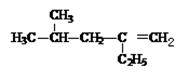
某烃A 0.2 mol 在氧气中完全燃烧后,生成CO2、H2O各1.2 mol。试回答下列问题:
(1)烃A的分子式为。
(2)若取一定量的烃A完全燃烧后,生成CO2和H2O各3 mol,则有g烃A参加了反应,燃烧时消耗标准状况下的氧气L。
(3)若烃A不能使溴水褪色,但在一定条件下能与氯气发生取代反应,其一氯取代物只有一种,则烃A的结构简式为。
(4)若烃A能使溴水褪色,在催化剂作用下,与H2加成,其加成产物经测定分子中含有4个甲基,则烃A可能的结构简式有。
有4种无色液态物质:己烯、己烷、苯和甲苯,符合下列各题要求的分别是
(1)不能与溴水或酸性KMnO4溶液反应,但在铁屑作用下能与液溴反应的是,生成的有机物名称是,此反应属于反应
(2)任何条件下都不能与溴水及酸性KMnO4溶液反应的是。
(3)能与溴水、酸性KMnO4溶液反应的是。
(4)不与溴水反应但与酸性KMnO4溶液反应的是。
在一只小烧杯里,加入20 g Ba(OH)2·8H2O粉末,将小烧杯放在事先已滴有3~4滴水的玻璃片上,然后加入10 g NH4+Cl晶体,并用玻璃棒迅速搅拌。
(1)实验中玻璃棒的作用是(该空2分)
(2)写出有关反应的化学方程式:(该空2分,余下各空1分)
该反应属反应(填基本反应类型)。
(3)实验中观察到的现象有、 且反应混合物成糊状,反应混合物呈糊状的原因是。
(4)通过现象,说明该反应为热反应,这是由于反应物的总能量生成物的总能量。