在反应2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O中:
(1) 元素得电子, 元素被氧化(填元素名称)。
(2)氧化产物与还原产物的粒子数目之比为_________,氧化剂与还原剂的粒子数目之比是 。
(3)若有7.3gHCl被氧化,则产生Cl2的质量为_______g。
(4)该反应的离子方程式为 。
纳米技术制成的金属固体燃料、氢气等已应用到社会生活和高科技领域。单位质量的A和B单质燃烧时均放出大量热,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
| 离能(kJ·mol-1) |
I1 |
I2 |
I3 |
I4 |
| A |
932 |
1 821 |
15 390 |
21 771 |
| B |
738 |
1 451 |
7 733 |
10 540 |
(1)某同学根据上述信息,推断B的核外电子排布如图所示,该同学所画的电子排布图违背了________。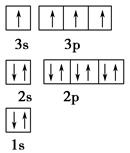
(2)ACl2分子中A的杂化类型为________。
(3)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。已知金刚石中的C—C的键长为154.45 pm,C60中C—C键长为145~140 pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确________,并阐述理由___________________。
(4)科学家把C60和钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体。写出基态钾原子的价电子排布式______________,该物质的K原子和C60分子的个数比为________。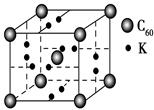
(5)继C60后,科学家又合成了Si60、N60,C、Si、N原子电负性由大到小的顺序是______________________________,NCl3分子的VSEPR模型为________。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则一个Si60分子中π键的数目为________。
有原子序数依次增大的A、B、C、D、E五种元素,A是短周期中族序数等于周期数的非金属元素;B元素的原子既不易失去,也不易得到电子,其基态原子每种轨道中电子数相同;C元素的价电子构型为nsnnpn+1;D的最外层电子数与电子层数之比为3∶1;E是地壳中含量仅次于铝的金属元素,其合金用途最广,用量最大。
(1)B与D形成的非极性分子中中心原子的孤电子对数是________,中心原子的杂化轨道类型为________。
(2)A分别与B、C、D能形成电子数为10的化合物,它们的沸点由高到低的顺序是________,它们的稳定性由弱到强的顺序是________。
B、C、D三种元素的电负性由大到小的顺序是________(用元素符号表示),第一电离能由大到小的顺序是________(用元素符号表示)。
(5)一个C的单质分子中存在________个π键、________个σ键。
(6)E的三种同素异形体,晶胞如图所示: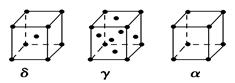
其中晶胞γ的堆积模型中E原子的配位数为________,该晶胞中所含原子数为________。
短周期非金属元素A、B、C的核电荷数依次增大,A原子的外围电子排布式为ns2np2,C是地壳中含量最多的元素。元素D、E都位于第四周期,其中E的核电荷数为29,D原子的核外未成对电子数在同周期中是最多的。请用对应的元素符号或化学式填空:
(1)元素A、B、C的第一电离能由小到大的顺序为________。
(2)已知(AB)2分子中键与键之间的夹角为180°,并有对称性,且每个原子的最外层电子数均满足8电子结构,则其结构式为________,1 mol该分子中含有的π键的数目为________。
(3)基态D原子的外围电子排布式为________。化合物DO2Cl2的熔点是-96.5 ℃,沸点是117 ℃,则固态DO2Cl2属于________晶体。
(4)已知元素E的氢化物的晶胞结构如图所示,则其化学式为___________________。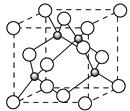
原子序数小于36的四种元素X、Y、Z、W,有关它们的信息如下表所示:
| 元素 |
部分结构知识 |
部分性质 |
| X |
X原子核外电子排布在三个能级上,且有三个电子能量相同 |
X有多种氧化物,如XO、XO2、X2O4等;通常情况下XO2与X2O4共存 |
| Y |
Y原子的最外层电子数等于次外层电子数的2倍 |
Y是形成化合物种类最多的元素 |
| Z |
Z原子的最外层电子数多于4 |
Z元素的最高正化合价与最低负化合价代数和等于6 |
| W |
W的一种核素质量数为52,中子数为28 |
+6价W的化合物有强氧化性,可用于皮革加工、吹气法检查司机是否酒驾等 |
请填写下列空白(答题时X、Y、Z、W用相应的元素符号):
(1)X单质分子的电子式是________,σ键和π键的个数比是________。
(2)Z元素原子最外层共有________种不同运动状态的电子。Z的氢化物液态时________(填“能”或“不能”)导电。
(3)W的基态原子核外电子排布式是_____________________________。
(创新预测题)(1)①在淀粉碘化钾溶液中,滴加少量次氯酸钠碱性溶液,立即会看到溶液变蓝色,这是因为________,离子方程式为__________________________。
②在碘和淀粉形成的蓝色溶液中,滴加亚硫酸钠碱性溶液,发现蓝色逐渐消失,这是因为______________________________。离子方程式是_______________________________。
③对比①和②实验所得的结果,将I2、ClO-、SO42—性由强到弱的顺序排列为_____________________________。
(2)今有铁片、铜片,设计实验证明以下事实,并写出反应的化学方程式。
①浓硫酸的氧化性比稀硫酸强。________________________________。
②氯化铁溶液中Fe3+的氧化性比硫酸铜溶液中的Cu2+强。__________________________。
③铁的还原性比铜强。
___________________________________________________________。