四种常见元素的性质或结构信息如下表。试根据信息回答有关问题。
| 元素 |
A |
B |
C |
D |
| 性质 结构 信息 |
原子核外有两个电子层,最外层有3个未成对的电子 |
原子的M层有1对成对的p电子 |
原子核外电子排布为[Ar]3d104s1, 有+1、+2两种常见化合价 |
有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
⑴写出B原子的电子排布式 。
⑵A元素的氢化物的沸点比同主族相邻元素氢化物沸点 (填“高”或“低”),其是__________________________。
⑶D的最高价氧化物的电子式: 。高温下D的氧化物还原赤铁矿的方程式为可逆反应,写出该反应的化学方程式___________________,该反应的平衡常数表达式K=___________。
⑷往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为________________,简要描述该配合物中化学键的成键情况__________________。
⑸下列分子结构图中的“ ”表示上述相关元素的原子中除去最外层电子的剩余部分,“
”表示上述相关元素的原子中除去最外层电子的剩余部分,“ ”表示氢原子,小黑点“
”表示氢原子,小黑点“ ”表示没有形成共价键的最外层电子,短线表示共价键。
”表示没有形成共价键的最外层电子,短线表示共价键。
则在以上分子中,中心原子采用sp3杂化形成化学键的且空间构型是角形的是 (填写序号);在②的分子中有 个σ键和 个π键。
⑹已知NH4+、N4H44+的空间构型均为四面体,NH4+的结构式为 \s\up10(∣←N-,\s\up10(∣H(→表示共用电子对由N原子单方面提供)。 请画出N4H44+的结构式_____________________。
氮及其化合物在工农业生产中具有重要作用。
(1)某小组进行工业合成氨N2(g)+3H2(g) 2NH3(g)△H<0的模拟研究,在1L密闭容器中,分别加入0.1mol N2和0.3mol H2。实验①、②、③中c(N2)随时间(t)的变化如图所示。
2NH3(g)△H<0的模拟研究,在1L密闭容器中,分别加入0.1mol N2和0.3mol H2。实验①、②、③中c(N2)随时间(t)的变化如图所示。
实验②从开始到达到平衡状态的过程中,用H2表示的平均反应速率为。与实验①相比,.实验②所采用的实验条件可能为(填字母),实验③所采用的实验条件可能为(填字母)。
a.增大压强b.减小压强c.升高温度d.降低温度e.使用催化剂
(2)NH3可用于处理废气中的氮氧化物,其反应原理为2NH3(g)+NO(g)+NO2(g) 2N2(g)+3H2O(g)△H<0欲提高废气中氮氧化物的转化率,可采取的措施是(填字母)
2N2(g)+3H2O(g)△H<0欲提高废气中氮氧化物的转化率,可采取的措施是(填字母)
a.升高温度 b.增大压强 c,增大NH3的浓度
(3)NCl3遇水发生水解反应,生成NH3的同时得到(填化学式)。ClO2是广谱高效消毒剂,制备原理为NCl3+6ClO2-+3H2O=NH3↑+6ClO2+3OH-+3Cl-。若转移1mol电子,则制取ClO2的质量为。
(4)25℃时,将amol·L-1的氨水与bmol·L-1盐酸等体积混合,反应后溶液恰好显中性,则ab(填“>”、“<”或“=”)。用a、b表示NH3·H2O的电离平衡常数为。
电子产品产生的大量电子垃圾对环境构成了极大的威胁。某化学兴趣小组将一批废弃的线路板简单处理后,得到含Cu、Al、Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
按要求回答下列问题:
(1)滤渣1中存在的金属有_____________。
(2)已知沉淀物的pH如下表:
| 氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
| Fe2+ |
7.0 |
9.0 |
| Fe3+ |
1.9 |
3.7 |
| Cu2+ |
4.9 |
6.7 |
| Al3+ |
3.0 |
4.4 |
①则操作②中X物质最好选用的是___________(填编号)
a.酸性高锰酸钾溶液 b.漂白粉 c.氯气 d.双氧水
②理论上应控制溶液pH的范围是________________________。
(3)检验滤液2中既不存在Fe2+又不存在Fe3+的操作步骤是____________________。
(4)用一个离子方程式表示在酸浸液中加入适量铝粉的反应:___________________。
(5)由CuSO4·5H2O制备CuSO4时,应把CuSO4·5H2O放在______(填仪器名称)中加热脱水。
(6)现在某些电器中使用的高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为 3Zn + 2K2FeO4 + 8H2O 3Zn(OH)2 + 2Fe(OH)3 + 4KOH,该电池放电时负极反应式为_______,每有1mol K2FeO4被还原,转移电子的物质的量为____,充电时阳极反应式为___________。
3Zn(OH)2 + 2Fe(OH)3 + 4KOH,该电池放电时负极反应式为_______,每有1mol K2FeO4被还原,转移电子的物质的量为____,充电时阳极反应式为___________。
近年来,碳和碳的化合物在生产生活实际中应用广泛。
(1)在2升的密闭容器中,充有2mol CO与4mol 水蒸气,在催化剂作用下进行如下化学反应:CO(g)+H2O(g) CO2(g)+H2(g),CO的转化率和温度t的关系如下表:
CO2(g)+H2(g),CO的转化率和温度t的关系如下表:
| t(℃) |
750 |
850 |
1000 |
| CO% |
0.7 |
2/3 |
0.5 |
1000℃时该反应的平衡常数为___________________。850℃时,向该容器中重新通入1mol CO、1.5mol H2O、0.5mol CO2和2molH2,此时反应___________(填“向右进行”、“向左进行”或“处于平衡状态”)。
(2)已知:C(s)+O2 (g) ===CO2(g) △H1=﹣393.5kJ·mol-1
2H2(g)+O2(g)===2H2O(g) △H2=﹣483.6kJ·mol-1
C(s)+H2O(g)===CO(g)+H2(g) △H3=+131.3kJ·mol-1
则CO和H2O生成CO2和H2的热化学方程式为_______________________________。
(3) 目前工业上可用CO2来生产燃料甲醇,有关反应为:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。现向体积为1 L的密闭容器中,充入
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。现向体积为1 L的密闭容器中,充入
1mol CO2和3mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
①从反应开始到平衡,氢气的平均反应速率v(H2)=_____________;
②若改变条件使平衡向正反应方向移动,则平衡常数______________(填序号)
a.可能不变b.可能减小 c.可能增大 d.不变、减小、增大皆有可能
(4)NaHCO3的水溶液呈碱性,其原因是(用文字叙述)_______________________。常温下,向100mL
0.2mol/LNaHCO3溶液中滴加amol/L的醋酸溶液,当滴加到溶液呈中性时,所用去的醋酸体积刚好也
为100mL,此时醋酸的电离常数为b, 用含b的代数式表示醋酸的浓度a=_____________________。

 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
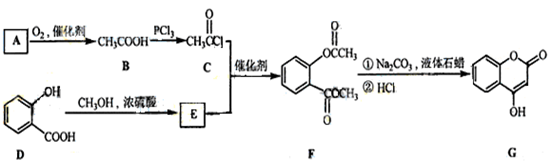
(1)A与银氨溶液反应有银镜生成,则A的结构简式为____________,1molG最多能与______molH2在催化剂作用下发生加成反应。
(2)检验C中含有Cl元素时,可选取的试剂是_________(填编号,按选取先后顺序排列)
a.氢氧化钠的水溶液 b.稀盐酸 c.硝酸银 d.稀硝酸
(3)写出F和过量NaOH溶液共热时反应的化学方程式______________________。
(4)H是E的同分异构体,H中苯环上有只有两个取代基,且位于苯环的对位,H可以使氯化铁溶液显紫色,可以和碳酸氢钠溶液反应放出气体,则H的结构简式为。
C、N、Si、Fe等元素及其化合物有重要的应用。
(1)上述四种元素的原子中,未成对电子数最多的元素是_________________。
(2)C元素是形成有机物的主要元素,下列分子中含有sp和sp3杂化方式的是__________(填写序号)。
(3)继C60之后,科学家又合成了Si60、N60。C、Si、N原子电负性由大到小的顺序是____________(用元素符号表示)。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为____________。
(4)一定条件下,C元素可形成多种晶体。图1是其中某种晶体的一个晶胞,该晶胞中含有___________个C原子。
(5)图2为金属铁某种晶体的晶胞结构,已知该晶体的密度为a g/cm3为阿伏加德罗常数的值,则该晶胞的体积为_________cm3.