近年来,碳和碳的化合物在生产生活实际中应用广泛。
(1)在2升的密闭容器中,充有2mol CO与4mol 水蒸气,在催化剂作用下进行如下化学反应:CO(g)+H2O(g) CO2(g)+H2(g),CO的转化率和温度t的关系如下表:
CO2(g)+H2(g),CO的转化率和温度t的关系如下表:
| t(℃) |
750 |
850 |
1000 |
| CO% |
0.7 |
2/3 |
0.5 |
1000℃时该反应的平衡常数为___________________。850℃时,向该容器中重新通入1mol CO、1.5mol H2O、0.5mol CO2和2molH2,此时反应___________(填“向右进行”、“向左进行”或“处于平衡状态”)。
(2)已知:C(s)+O2 (g) ===CO2(g) △H1=﹣393.5kJ·mol-1
2H2(g)+O2(g)=== 2H2O(g) △H2=﹣483.6kJ·mol-1
C(s)+H2O(g)=== CO(g)+H2(g) △H3=+131.3kJ·mol-1
则CO和H2O生成CO2和H2的热化学方程式为_______________________________。
(3) 目前工业上可用CO2来生产燃料甲醇,有关反应为:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。现向体积为1 L的密闭容器中,充入
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。现向体积为1 L的密闭容器中,充入
1mol CO2和3mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
①从反应开始到平衡,氢气的平均反应速率v(H2)=_____________;
②若改变条件使平衡向正反应方向移动,则平衡常数______________(填序号)
a.可能不变 b.可能减小 c.可能增大 d.不变、减小、增大皆有可能
(4)NaHCO3的水溶液呈碱性,其原因是(用文字叙述)_______________________。常温下,向100mL
0.2mol/LNaHCO3溶液中滴加amol/L的醋酸溶液,当滴加到溶液呈中性时,所用去的醋酸体积刚好也
为100mL,此时醋酸的电离常数为b, 用含b的代数式表示醋酸的浓度a=_____________________。
碳、氮及其化合物在工农业生产生活中有着重要作用。请回答下列问题:
(1)用CH4 催化还原NOx 可以消除氮氧化物的污染。例如:
CH4(g) + 4NO2(g) = 4NO(g)+CO2(g) + 2H2O(g)ΔH1=-574 kJ·mol-1
CH4(g) + 4NO(g) =" 2" N2(g)+CO2(g) + 2H2O(g)ΔH2
若2 mol CH4 还原NO2 至N2,整个过程中放出的热量为1734 kJ,则ΔH2= ;
(2)据报道,科学家在一定条件下利用Fe2O3与甲烷反应可制取“纳米级”的金属铁。其反应如下:Fe2O3(s) + 3CH4(g)  2Fe(s) + 3CO(g) +6H2(g)ΔH>0
2Fe(s) + 3CO(g) +6H2(g)ΔH>0
① 若反应在5L的密闭容器中进行,1min后达到平衡,测得Fe2O3在反应中质量减少3.2g。则该段时间内CO的平均反应速率为 _________ 。
② 若该反应在恒温恒压容器中进行,能表明该反应达到平衡状态的是_____(选填序号)
a.CH4的转化率等于CO的产率
b.混合气体的平均相对分子质量不变
c.v(CO)与v(H2)的比值不变
d.固体的总质量不变
③ 该反应达到平衡时某物理量随温度变化如图所示,当温度由T1升高到T2时,平衡常数KA____KB(填“>”、“ <”或“=”)。纵坐标可以表示的物理量有哪些 。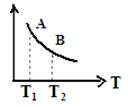
a.H2的逆反应速率
b.CH4的的体积分数
c.混合气体的平均相对分子质量
A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球。关闭K2,将等量且少量的NO2通过K1、K3分别充人A、B中,反应起始时,A、B的体积相同。(已知:2NO2  N2O4;△H<0)
N2O4;△H<0)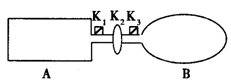
(1)一段时间后,反应达到平衡,此时A、B中生成的N2O4的速率是VA_______VB。(填“>”、“<”、“=”);若打开活塞K2,气球B将___________(填:变大、变小、不变)。
(2)若在A、B中再充入与初始量相等的NO2,则达到平衡时,NO2的转化率αA将______(填增大或减小、不变);若通入等量的Ne气,则达到平衡时,A中NO2的转化率将_____,B中NO2的转化率将_______(填: 变大、变小、不变)。
(3)室温下,若A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时,___________中的颜色较深。
二甲醚(DME)一种清洁的替代燃料,不含硫,不会形成微粒,而且与汽油相比,排放的NO2更少,因此是优良的柴油机替代燃料。工业上利用一步法合成二甲醚的反应如下(复合催化剂为CuO/ZnO/Al2 O2):2CO(g)+4H2(g) CH3OCH3(g)+H2O(g) △H=-204.7kJ/mol。
CH3OCH3(g)+H2O(g) △H=-204.7kJ/mol。
(1)600℃时,一步法合成二甲醚过程如下:
CO(g)+2H2(g)=CH3OH(g)△H1=-100.46kJ/mol
2CH3OH(g)=CH3OCH3(g)+H2O(g) △H2
CO(g)+H2O(g)=CO2(g)+H2(g)△H3=-38.7kJ/mol
则△H2= 。
(2)以DME为燃料,氧气为氧化剂,在酸性电解质溶液中用惰性电极制成燃料电池,则通入氧气的电极是电源的 (填正、负)极,通DME的电极反应为 。
写出下列反应的热化学方程式或电极反应式:
(1)N2(g)与H2(g)反应生成1molNH3(g),放出46.1kJ热量 。
(2)钢铁发生吸氧腐蚀时的正极电极反应式 。
(3)CH4与O2在酸性条件下形成原电池时,负极的电极反应式 。
液氨气化后,分解产生的氢气可作为氢氧燃料电池的燃料。氨气分解反应的热化学方程式如下:
2NH3(g)  N2 (g) + 3H2(g)DH =" +" a kJ·mol-1
N2 (g) + 3H2(g)DH =" +" a kJ·mol-1
请回答下列问题:
(1)已知:2H2 (g) + O2 (g) =2H2O(l)DH =" -" b kJ·mol-1
NH3 (g)  NH3(l)DH =" -" c kJ·mol-1
NH3(l)DH =" -" c kJ·mol-1
则4NH3(l) + 3O2 (g) = 2N2 (g) + 6H2O(l) 的DH = kJ·mol-1。
(2)水能发生电离:2H2O(l)  H3O++OH-,液氨也能发生类似的电离。请写出液氨的电离方程式 。
H3O++OH-,液氨也能发生类似的电离。请写出液氨的电离方程式 。
(3)实验室用Pt电极对液氨进行电解可以得到H2和N2 ,若电解过程中阳极收集得到4.48L气体(标况),则转移的电子的数目是 ,标准状况下阴极得到的气体的质量为 g。