(1)由盖斯定律结合下述反应方程式,回答问题:
(1)NH3(g)+HCl(g)=NH4Cl(s) △H= —176KJ/moL
(2)NH3(g)+H2O(l)=NH3﹒H2O(aq) △H= —35.1KJ/moL
(3)HCl(g)+H2O(l)=HCl(aq) △H= —72.3KJ/moL
(4)NH3﹒H2O(aq)+ HCl(aq)= NH4Cl(aq) △H= —52.3KJ/moL
则NH4Cl(s)+2 H2O(l)= NH4Cl(aq)是 热反应,其反应热的热效应值是 KJ/moL。
(2)在25℃,101KPa下,1克的一氧化碳完全燃烧生成二氧化碳时放热10.1KJ.请写出一氧化碳燃烧热的热化学方式 ,此反应熵的变化情况 (填熵增、熵减、不变)。
(3)科学家预言,燃料电池将成为20世纪获得电力的重要途径。用两种或多种碳酸盐的低熔点混合物为电解质,采用吸渗锦粉作阴极,多孔性氧化镁作阳极,以含一氧化碳为主要成分的阳极燃料气,混有CO2的空气为阴极燃气,在650℃电池中发生电极反应,这种电池在国外已经问世。请写出有关的反应式。
负极反应:
正极反应:
在无土栽培中,配制1 L内含0.5 mol/L NH4Cl、0.16 mol/L KCl、0.24 mol/L K2SO4的某营养液,若用KCl、NH4Cl、(NH4)2SO4配制,则需这三种固体的物质的量分别为,,。
书写下列物质在水溶液中的电离方程式:
CH3COOH:__________________________________
Ca(OH)2:___________________________________
NH3.H2O:________________________________________
NH4HSO4:________________________________________
H2CO3:_______________________________________________
NaHCO3:_______________________________________________
(1)现有以下物质:①NaCl晶体 ②干冰 ③液态的醋酸 ④铜 ⑤BaSO4固体⑥蔗糖⑦酒精 ⑧熔融的KNO3 ⑨浓HNO3
回答下列问题(填序号)
以上物质能导电的是_________________________________;以上物质属于非电解质的是___________________________;以上物质属于电解质的是___________________________;
(14分)如下图所示,某同学设计一个甲醚(CH3OCH3)燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。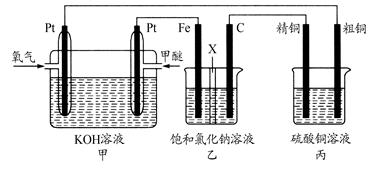
根据要求回答相关问题:
(1)通入氧气的电极为________(填“正极”或“负极”),写出负极的电极反应式_______________________________。
(2)铁电极为________(填“阳极”或“阴极”),石墨电极(C)的电极反应式为________________________________________。
(3)反应一段时间后,乙装置中生成氢氧化钠主要在________(填“铁极”或“石墨极”)区。
(4)如果粗铜中含有锌、银等杂质,丙装置中阳极上电极反应式为___________,反应一段时间,硫酸铜溶液浓度将________(填“增大”“减小”或“不变”)。
(5)若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁电极上生成的气体的标况下的体积为________;丙装置中阴极析出铜的质量为________。
电解原理在化学工业中有广泛应用。图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题: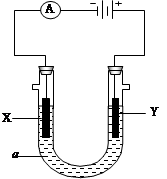
①若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
电解池中X极上的电极反应式为。
在X极附近观察到的现象是。
②Y电极上的电极反应式为,
检验该电极反应产物的方法是。
(2)如要在某导电塑料表面镀一层金属铜,则
①X电极的材料是,电极反应式是。
②Y电极的材料是,电解液a选用溶液,。
(说明:杂质发生的电极反应不必写出)