)设反应①Fe(s)+CO2(g) FeO(s)+CO(g) △H = Q1的平衡常数为K1,
FeO(s)+CO(g) △H = Q1的平衡常数为K1,
反应②Fe(s)+H2O(g) FeO(s)+H2(g) △H = Q2的平衡常数为K 2,在不同温度下,K1、K2的值如下:
FeO(s)+H2(g) △H = Q2的平衡常数为K 2,在不同温度下,K1、K2的值如下:
| 温度( T ) |
K1 |
K2 |
| 973 |
1.47 |
2.38 |
| 1173 |
2.15 |
1.67 |
(1)从上表可推断,反应①是_______(填“放”或“吸”)热反应;K2的数学表达式为 。
(2)现有反应③H2(g)+CO2(g) CO(g)+H2O(g)△H = Q3 ①根据反应①与②推导出K1、K2、K3的关系式K3=_____________;可推断反应③是________(填“放”或“吸”)热反应。要使反应③在一定条件下建立的平衡右移,可采取的措施有__________。
CO(g)+H2O(g)△H = Q3 ①根据反应①与②推导出K1、K2、K3的关系式K3=_____________;可推断反应③是________(填“放”或“吸”)热反应。要使反应③在一定条件下建立的平衡右移,可采取的措施有__________。
| A.缩小容器体积 | B.降低温度 | C.使用合适的催化剂 |
| D.设法减少CO的量E.升高温度 |
②根据反应①与②推导出Q1、Q2、Q3的关系式Q3 =_____________。
利用LiOH和钴氧化物可制备锂离子电池正极材料.LiOH可由电解法制备,钴氧化物可通过处理钴渣获得.
(1)利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液.B极区电解液为 溶液(填化学式),阳极电极反应式为 ,电解过程中Li+向 电极迁移(填“A”或“B”).
(2)利用钴渣[含Co(OH)3、Fe(OH)3等]制备钴氧化物的工艺流程如下:
Co(OH)3溶解还原反应的离子方程式为 ,铁渣中铁元素的化合价为 ,在空气中煅烧CoC2O4生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为1.344L(标准状况),则钴氧化物的化学式为 。
用NH3催化还原NxOy可以消除氮氧化物的污染。
已知:反应I: 4NH3(g)+6NO(g)  5N2(g)+6H2O(l) △H1
5N2(g)+6H2O(l) △H1
反应II: 2NO(g)+O2(g)  2NO2(g) △H2(且|△H1| =2|△H2|)
2NO2(g) △H2(且|△H1| =2|△H2|)
反应III:4NH3(g)+6NO2(g)  5N2(g)+3O2(g)+6H2O(l) △H3
5N2(g)+3O2(g)+6H2O(l) △H3
反应I和反应II在不同温度时的平衡常数及其大小关系如下表
| 温度/K |
反应I |
反应II |
已知: |
| 298 |
K1 |
K2 |
|
| 398 |
K1′ |
K2′ |
(1)△H3 = (用△H1、△H2 的代数式表示);推测反应III是 反应(填“吸热”或“放热”)
(2)相同条件下,反应I在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图所示。
①计算0~4分钟在A催化剂作用下,反应速率v(NO)= 。
②下列说法不正确的是 。
A.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
B.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
C.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
D.增大压强能使反应速率加快,是因为增加了活化分子百分数
(3)一定条件下,反应II达到平衡时体系中n(NO)∶n(O2)∶n(NO2)=2∶1∶2。恒温恒压时,在其它条件不变时,再充入NO2气体, NO2体积分数 (填“变大”、“变小”或“不变”)
(4)电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下,溶液中OH-向电极 移动(填a或b),负极的电极反应式为 。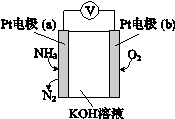
在实验室中,可利用碳酸氢钠、氯化钠、氯化铵等物质溶解度的差异,通过饱和食盐水、氨和二氧化碳反应,获得碳酸氢钠晶体,反应原理可用如下化学方程式表示:NH3 + CO2 + NaCl + H2O ="=" NH4Cl + NaHCO3↓,依据此原理,欲制得碳酸钠晶体,某校学生设计了如下实验装置,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和:
(1)A装置中所发生反应的离子方程式为: 。
C装置中稀硫酸的作用为: 。
(2)下表中所列出的是相关物质在不同温度下的溶解度数据(g/100g水)
| 0℃ |
10℃ |
20℃ |
30℃ |
40℃ |
50℃ |
|
| NaCl |
35.7 |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
| NaHCO3 |
6.9 |
8.1 |
9.6 |
11.1 |
12.7 |
14.5 |
| NH4Cl |
29.4 |
33.3 |
37.2 |
41.4 |
45.8 |
50.4 |
参照表中数据,请分析B装置中使用冰水是因为 。
(3)该校学生在检查完此套装置气密性后进行实验,结果没有得到碳酸氢钠晶体,指导教师指出应在 装置之间(填写字母)连接一个盛有 的洗气装置,其作用是 。
(4)若该校学生进行实验时,所用饱和食盐水中含NaCl的质量为5.85g,实验后得到干燥的NaHCO3晶体的质量为5.04g,则NaHCO3的产率为 。
从樟科植物枝叶提取的精油中含有下列甲、乙两种成分:
(1)乙中所含官能团的名称为 。
(2)由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):
设计步骤①的目的是 ;指出①的反应类型 。
③反应的化学方程式为 (注明反应条件)。
(3)欲检验乙中的含氧官能团,选用下列的一种试剂是__________。
| A.溴水 | B.酸性高锰酸钾溶液 | C.溴的CCl4溶液 | D.银氨溶液 |
(4)乙经过氢化、氧化得到丙( 。丙的同分异构体中,既有苯环,又有羧基的共有 种。任意写出一种同时符合下列要求的丙的同分异构体结构简式_____________。
。丙的同分异构体中,既有苯环,又有羧基的共有 种。任意写出一种同时符合下列要求的丙的同分异构体结构简式_____________。
①能发生银镜反应;
②能与FeCl3溶液发生显色反应;
③核磁共振氢谱图上产生4个吸收峰。
某化学兴趣小组利用废弃铝矿(含CuO、Al2O3及SiO2),模拟工业上提取铝的工艺,设计如下图所示的简单操作流程:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
回答下列问题:
(1)滤渣主要成分的化学式为_________。
(2)灼烧Al(OH)3时,用到多种硅酸盐质的仪器,除玻璃棒、酒精灯、泥三角外,还有_______(填仪器名称)。
(3)溶液Y中要加入稍过量原料A,原料A的化学式是_______。
(4)操作流程中③的离子方程式为_____________。
(5)铝电池性能优越,Al—Ag2O电池可用作水下动力电源,其原理如图所示:
请写出该电池正极反应式 。