醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应方程式和实验装置如下: 
可能用到的有关数据如下:
| |
相对分 子质量 |
密度/ (g·cm-3) |
沸点/℃ |
溶解性 |
| 环己醇 |
100 |
0.961 8 |
161 |
微溶于水 |
| 环己烯 |
82 |
0.810 2 |
83 |
难溶于水 |
合成反应:
在a中加入20 g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1 mL浓硫酸。b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90 ℃。
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5% 碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙。最终通过蒸馏得到纯净环己烯10 g。
(1)装置b的名称是__________。
(2)加入碎瓷片的作用是________;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是________(填正确答案序号)。
A.立即补加 B.冷却后补加
C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为______________。
(4)分液漏斗在使用前必须清洗干净并______。在本实验分离过程中,产物应该从分液漏斗的________(填“上口倒出”或“下口倒出”)。
(5)分离提纯过程中加入无水氯化钙的目的是__________________。
(6)在环已烯粗产物蒸馏过程中,不可能用到的仪器有______(填正确答案序号)。
A.圆底烧瓶 B.温度计 C.吸滤瓶 D.球形冷凝管 E.接收器
用电子式表示下列物质的结构:
(1)NH4Cl____________;(2)Na2O________________;(3)Na2O2________;(4)H2S________;(5)CO2________;(6)MgCl2________;
(1)~(6)中,仅含离子键的是________,仅含共价键的是________,既有离子键又有共价键的是________。
科学家发现:具有2、8、20、28、50、82、114、126等数目的质子或中子的原子核具有特别的稳定性,并将这些偶数称为“幻数”,而具有双幻数的 He、
He、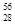 Ni、
Ni、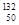 Sn、Pb等尤为稳定。根据此信息回答下列问题:
Sn、Pb等尤为稳定。根据此信息回答下列问题:
(1)写出前三种质子数为“幻数”的元素原子的结构示意图,并标明元素符号__________________。
(2)已知氧有三种同位素 O、
O、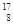 O、
O、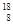 O,根据上述“幻数”规律,氧的同位素中原子核最稳定的是________。
O,根据上述“幻数”规律,氧的同位素中原子核最稳定的是________。
(3)根据现有元素周期律推算,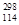 R位于元素周期表的第________周期第________族,核稳定性
R位于元素周期表的第________周期第________族,核稳定性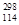 R__________
R__________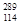 R(填“>”、“<”或“=”)。
R(填“>”、“<”或“=”)。
a、b、c、d是四种短周期元素,a、b、c同周期,c、d同主族。a的原子结构示意图为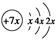 ,b与d形成的化合物的电子式为
,b与d形成的化合物的电子式为 ,则下列叙述中正确的是
,则下列叙述中正确的是
( )。
| A.原子序数:a>b>c | B.d单质最活泼 |
| C.原子半径:a>c>d | D.最高价氧化物对应的水化物的酸性:d>a>c |
氮化钠(Na3N)是一种实施管制的化学品,它是科学家制备的一种重要的化合物,与水作用可产生NH3。
请回答下列问题:
(1)Na3N的电子式是____________,该化合物是由________键形成的。
(2)Na3N与盐酸反应生成________种盐,其电子式分别是________。
(3)Na3N与水的反应属于________(填基本反应类型)反应。
(4)比较Na3N中两种微粒的半径:
r(Na+)________r(N3-)(填“>”“=”或“<”)。
标号为①~⑩的元素,在元素周期表中的位置如下:
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0族 |
| 1 |
① |
② |
||||||
| 2 |
③ |
④ |
⑤ |
⑥ |
||||
| 3 |
⑦ |
⑧ |
⑨ |
⑩ |
试回答下列问题:
(1)其原子只要形成一对共用电子对就达到了稳定结构的元素是________。(填写元素符号)
(2)①和④号元素形成的化合物的化学式为________,用电子式表示其形成过程为________。
(3)⑧号元素的最高价氧化物的水化物的化学式是____________________。
(4)①、⑤、⑦号元素形成的一种化合物的电子式是________,在该化合物中既含有________键,又含有________键。