主族元素A、B、C、D都是短周期元素,A、D同主族,B、C在同一周期,A、D原子的最外层电子数都是1,C原子最外层电子数比B原子少2个,且最外层电子数是次外层电子数的2倍。A、B单质在常温下均为气体。它们在一定条 件下以体积比2∶1完全反应,生成物在常温下是液体。此液体与D单质能剧烈反应生成A的单质。所得溶液中含有与氖原子的电子层结构相同的阳离子。
件下以体积比2∶1完全反应,生成物在常温下是液体。此液体与D单质能剧烈反应生成A的单质。所得溶液中含有与氖原子的电子层结构相同的阳离子。
回答下列问题:(1)写出元素符号A____,B____,C____,D____。
(2)写出B单质与D在加热反应后生成物质的化学式___________ ___________。
___________。
下图是一种治疗关节炎止痛药(F)的传统合成法路线图:
请回答下列问题:
(1)A→B的化学方程式为。
(2)C分子中手性碳原子数目为;D→E的反应类型。
(3)E在酸性条件下发生水解反应生成F和无机盐,该无机盐中的阳离子为。
(4)比F少5个碳原子的同系物X有多种同分异构体,其中满足下列条件的X的同分异构体结构简式为(写出任意一种)。
①属于芳香族化合物,②苯环上只有1个取代基,③属于酯类物质
(5)改良法合成该关节炎止痛药(F)是以2-甲基-1-丙醇、苯为原料合成的,产率和原子利用率都比较高。试写出改良法合成该关节炎止痛药(F)的合成路线图(乙酸酐和其他无机试剂任选)。合成路线流程图示例如下:
CH3CH2OH CH2=CH2
CH2=CH2 Br-CH2CH2-Br
Br-CH2CH2-Br
已知:①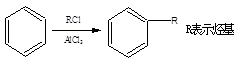
②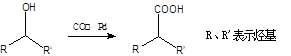
锶(Sr)为第5周期ⅡA族元素。高纯六水氯化锶晶体(SrCl2·6H2O)具有很高的经济价值,61℃时晶体开始失去结晶水,100℃时失去全部结晶水。用工业碳酸锶粉末(含少量Ba、Fe的化合物等杂质)制备高纯六水氯化锶晶体的过程如图所示。
请回答下列问题:
(1)操作①加快反应速率的措施有(任写一种方法即可)
(2)加入少量30% H2O2溶液的目的是
(3)步骤③中调节溶液PH至8—10,宜选用的试剂为____________(填序号)。
A.氨水 B.氢氧化锶粉末 C.氢氧化钠 D.氧化锶粉末
所得滤渣的主要成分是_______、(填化学式)。
(4)步骤⑤中,洗涤氯化锶晶体选用少量冰水的原因是
工业上用热风吹干六水氯化锶,选择的适宜温度范围是________________。
A.50~60℃ B.70~80℃ C.80~100℃ D.100℃以上
(5)若滤液中Ba2+浓度为1×10-5mol/L,依据右表数据可以推算滤液中Sr2+物质的量浓度为___________________。
【化学------必修】(15分)
Ⅰ、在稀硫酸酸化的含6 mol KI溶液中逐滴加入KBrO3溶液,整个过程中含碘物质与所加入KBrO3物质的量的关系如图。
请回答下列问题:
(1)b点时,对应含碘物质的化学式为。
(2)b→c过程中,仅有一种元素发生化合价变化,写出该反应的化学方程式并标出电子转移方向与数目。
(3)当n(KBrO3)=4mol时,体系中对应含碘物质的化学式为。
(4)酸性条件下,Br2、IO3-、BrO3-、I2氧化性由强到弱的顺序为。
(5)在稀硫酸酸化的KBrO3溶液中不断滴入淀粉KI溶液,边滴边振荡。则实验过程中的可能观察到的现象为。
Ⅱ、(6)氨水和NH4Cl等物质的量混合配制成的稀溶液,c(Cl-)<c(NH4+),下列说法错误的是( )
A氨水的电离作用大于NH4Cl的水解作用 B氨水的电离作用小于NH4Cl的水解作用
C氨水的存在抑制了NH4Cl的水解 DNH4Cl的存在抑制了氨水的电离
E、 c(H+)>c(OH-) F、 c(NH3•H2O)>c(NH4+)
G、c(NH3•H2O)+c(NH4+)=2c(Cl-) H、c(NH3•H2O)+c(OH-)=c(Cl-)+c(H+)
【化学------选修物质结构与性质】
五种短周期元素甲、乙、丙、丁、戊的原子序数依次增大,甲和丙同族,乙离子和丙离子具有相同的电子层结构。甲和乙、丁、戊均能形成共价型化合物。甲和乙形成的化合物在水中呈碱性,单质丁在单质戊中可燃烧产生白色烟雾。回答下列问题:
(1)五种元素中,原子半径最大的是,非金属性最强的是;(填元素符号)
(2)由甲和乙、丁、戊所形成的共价型化合物中,热稳定性最差的是;(用化学式表示);
(3)甲和乙形成的化合物的中心原子的杂化类型为;甲和乙形成的化合物可与甲和戊形成的化合物反应,其产物中存在的化学键类型为;
(4)除乙外,上述元素的电负性从大到小依次为;(填元素符号);
(5)单质戊与水反应的离子方程式为;
(6) 一定条件下1.86g单质丁与2.912L单质戊(标准状况)反应, 则产物为,(用化学式表示)其物质的量之比为。
【化学——选修化学与技术】
明矾石经处理后得到明矾[ KAl(SO4)2·12H2O]。从明矾制备Al、K2SO4和H2SO4的工艺过程如下所示:

焙烧明矾的化学方程式为:4KAl(SO4)2·12H2O+3S=2K2SO4 +2Al2O3+9SO2+48H2O
请回答下列问题: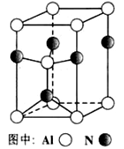 (1)在焙烧明矾的反应中,还原剂是;
(1)在焙烧明矾的反应中,还原剂是;
(2)从水浸后的滤液中得到K2SO4晶体的方法是;
(3)A12O3在一定条件下可制得AIN,其晶体结构如右图所示,该晶体中Al的配位数是;
(4)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是;
(5)焙烧产生的SO2可用于制硫酸。已知25℃、101 kPa时:
2SO2(g) +O2(g) 2SO3(g)△H1= 一197 kJ/mol;
2SO3(g)△H1= 一197 kJ/mol;
2H2O (g)=2H2O(1)△H2=一44 kJ/mol;
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H3=一545 kJ/mol。
则SO3 (g)与H2O(l)反应的热化学方程式是;
(6)焙烧948吨明矾(M=474 g/mol ),若SO2的利用率为96%,可生产质量分数为98%的硫酸吨。