在密闭容器中进行反应①Fe(s)+C02(g)  FeO(s)+CO(g) ΔH1=akJ·mol一
FeO(s)+CO(g) ΔH1=akJ·mol一
反应②2CO(g)+02(g)  2C02(g) △H2="b" kJ·mol-
2C02(g) △H2="b" kJ·mol-
反应③2Fe(s)+02(g)  2FeO(s)△H3
2FeO(s)△H3
(1) △H3= (用含a、b的代数式表示)。
(2)反应①的化学平衡常数表达式K= ,已知500℃时反应①的平衡常数K=1.0,在此温度下2 L密闭容器中进行反应①,Fe和C02的起始量均为2.0 mol,达到平衡时CO2的转化率为 ,CO的平衡浓度为 。
(3)将上述平衡体系升温至700℃,再次达到平衡时体系中CO的浓度是C02浓度的两倍,则a 0(填“>”、“<”或“=”)。为了加快化学反应速率且使体系中CO的物质的量增加,其他条件不变时,可以采取的措施有 (填序号)。
A.缩小反应器体积 B.再通入CO2 c.升高温度 D.使用合适的催化剂
(4)下列图像符合反应①的是 (填序号)(图中V是速率、φ为混合物中CO含量,T为温度)。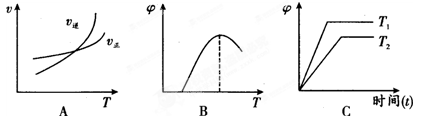
现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。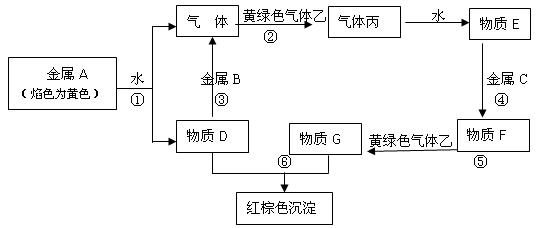
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:A、B、C、
F、 H、乙
(2)写出下列反应化学方程式:
反应①
反应⑤
反应⑥
氰(CN)2、硫氰(SCN)2的化学性质和卤素(X2)很相似,化学上称为拟卤素。它们阴离子的还原性强弱为Cl-<Br-<CN-<SCN-<I-。试写出
①(CN)2与KOH溶液反应的化学方程式:
_________________________________________________________________;
②在NaBr和KSCN的混合溶液中加入(CN)2,反应的离子方程式:
_____________________________________________________________________。
甲、乙两相邻的化工厂,排放的污水经处理后,仍然各溶有以下八种离子(Ag+、Fe3+、Ba2+、Na+、Cl-、SO42-、NO3-、OH-)中各不相同的 4种,若单独排放,则造成环境污染,如果将甲、乙两厂的污水按适当比例充分混合,再经沉淀后,排放的污水转变为无色澄清的NaNO3溶液,污染程度大为降低,又经测定,甲厂污水的pH大于7,试推断:
(l)甲厂污水中含有的4种离子是;
(2)乙厂污水中含有的4种离子是.
防治碘缺乏病的碘添加剂是KIO3(如加碘盐),可用盐酸酸化的KI淀粉混合液检验食盐是否加碘,其反应的离子方程式为:
通常用小苏打的悬浊液除去CO2中的HCl,反应的离子方程式为:
,
不能用NaOH溶液的原因是,
也不能用NaCO3的原因是(用离子方程式表示原因)