某化学研究性学习小组讨论Fe3+和SO32—之间发生怎样的反应,提出了两种可能:
一是发生氧化还原反应:2Fe3++SO32—+H2O=2Fe2++SO42—+2H+;
二是发生双水解反应:2Fe3++3SO32—+6H2O=2Fe(OH)3(胶体)+3H2SO3。
为了证明是哪一种反应发生,同学们设计并实施了下列实验,请填写下列空白:
【实验Ⅰ】学生选择的实验用品:Na2SO3浓溶液、BaCl2稀溶液、稀盐酸;试管若干、胶头滴管若干。从选择的药品分析,作者设计这个实验的目的是 。
【实验Ⅱ】取5mLFeCl3浓溶液于试管中,逐滴加入Na2SO3浓溶液,观察到溶液颜色由黄色变为红棕色,无气泡产生,无沉淀生成,继续加入Na2SO3浓溶液至过量,溶液颜色加深,最终变为红褐色。这种红褐色“液体”是 ;向红褐色液体中逐滴加入稀盐酸至过量,可以观察到的现象是. ;
将溶液分成两等份,其中一份加入KSCN溶液,溶液变成血红色,另一份加入BaCl2稀溶液,有少量白色沉淀生成。产生血红色现象的离子方程式是 。
【实验Ⅲ】换用稀释的FeCl3和Na2SO3溶液重复实验,Ⅱ、Ⅲ产生的现象完全相同。由上述实验得出的结论是 ;
若在FeCl3浓溶液中加入Na2CO3浓溶液,观察到红褐色沉淀并且产生无色气体,该反应的离子方程式是. 。
从形式上看,Na2CO3和Na2SO3相似,但是从上述实验中可以看到,二者的水溶液与氯化铁溶液反应的现象差别很大,分析其原因可能是:
① ;
② 。
(1)铝土矿的主要成分是Al2O3·3H2O,假设杂质是Fe2O3,写出由铝土矿制备金属铝的各步骤的化学方程式。(2013年高考题片段,源于高一教材)
(2)炼铁的原料有赤铁矿(假设杂质为SiO2)、焦炭、石灰石,设备为高炉,写出炼铁时所发生的主要的化学反应方程式
(3)工业上用石英砂先煅烧制取粗硅,最后经过还原反应制取高纯硅,其反应方程式分别为:
(4)假设没有Fe,生活会
假设没有Al,生活会
假设没有Si,生活会
(1)填空:填写合理的物质的结构简式:含氢量最大的有机物是;能证明CH4是正四面体结构的有机物是;能证明苯分子中不含简单的碳碳单键和碳碳双键的有机物是;苯的同系物 : 分子式为C9H12苯环上一氯代物只有一种的是 ;检验苯和甲苯的物质是(填写物质名称)。
(2)有机化学已经学了一段时间了。如果你对哪种有机物的结构、性质、用途有独到的见解,请用精炼的积极向上的富有哲理的语言描述.示例:CH3CH2OH:李白斗酒诗百篇.或者酒壮英雄胆,酒是惹祸源。但不要写无酒不成席。
示例:苯:眼中有双键,心中无双键。或者夜阑卧听风吹雨,苯环结构入梦来。
利用太阳光分解水制氢是未来解决能源危机的理想方法之一。某研究小组设计了如下图所示的循环系统实现光分解水制氢。反应过程中所需的电能由太阳能光电池提供,反应体系中I2和Fe3+等可循环使用。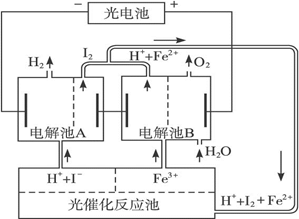
(1)写出电解池A、电解池B和光催化反应池中反应的离子方程式。
(2)若电解池A中生成3.36 L H2(标准状况),试计算电解池B中生成Fe2+的物质的量。
(3)若循环系统处于稳定工作状态时,电解池A中流入和流出的HI浓度分别为a mol·L-1和b mol·L-1,光催化反应生成Fe3+的速率为c mol·L-1,循环系统中溶液的流量为Q(流量为单位时间内流过的溶液体积)。试用含所给字母的代数式表示溶液的流量Q。
已知烃B分子内C、H原子个数比为1︰2,相对分子质量为28,核磁共振氢谱显示分子中只有一种化学环境的氢原子,且有如下的转化关系:
(1)B的结构简式是
(2)A可能属于下列哪类物质___________
a.醇 b.卤代烃 c.酚 d.羧酸
(3)反应①是D与HCl按物质的量之比1︰1的加成反应,则D的分子式是___________。
反应②可表示为:G + NH3 → F + HCl (未配平),该反应配平后的化学方程式是(有机化合物均用结构简式表示):
化合物E(HOCH2CH2Cl)和 F [ HN(CH2CH3)2 ]是药品普鲁卡因合成的重要中间体,普鲁卡因的合成路线如下:(已知: 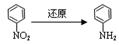 )
)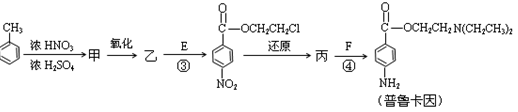
(4)甲的结构简式是 _________________。
由甲苯生成甲的反应类型是_________________。
(5)乙中有两种含氧官能团,反应③的化学方程式是
(6)丙中官能团的名称是。
(7)普鲁卡因有两种水解产物丁和戊。
①戊与甲互为同分异构体,戊的结构简式是_____________________。
②戊经聚合反应制成的高分子纤维广泛用于通讯、宇航等领域。该聚合反应的化学方程式是。
③ D的红外光谱表明分子内除C—H键、C—C键外还含有两个C—O单键。则D与F在一定条件下反应生成丁的化学方程式是________________________________。
为了证明CO具有还原性,有人利用下列装置设计了系列的实验,其中A为气体发生装置,C为尾气处理装置,X装置可以盛放不同的试剂重复使用。已知草酸与浓硫酸共热发生如下反应: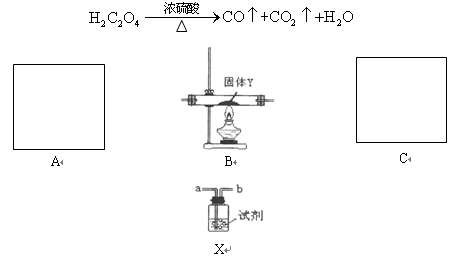
(1)若以草酸.浓硫酸为原料制备一氧化碳,则该气体发生装置中所用到的玻璃仪器除了导管外,还有______________________________。
(2)装置连接无误,装入药品后,在加热装置B之前应进行的一步操作是__________,C中尾气的的处理方法是______________________________。
(3)已知B中固体为CuO,现要制得纯净干燥的CO以验证其还原性,则A.B之间放置的X装置(可重复)中所装试剂依次为:____________________, 澄清石灰水,____________________,证明CO具有还原性的现象为____________________。
(4)除上述现象外,若再用一次X装置,还有一种能说明CO具有还原性的现象,
则装置X的安装位置及所装试剂为:______________________________,现象为:________________________________________。