已知烃B分子内C、H原子个数比为1︰2,相对分子质量为28,核磁共振氢谱显示分子中只有一种化学环境的氢原子,且有如下的转化关系:
(1)B的结构简式是
(2)A可能属于下列哪类物质___________
a.醇 b.卤代烃 c.酚 d.羧酸
(3)反应①是D与HCl按物质的量之比1︰1的加成反应,则D的分子式是___________。
反应②可表示为:G + NH3 → F + HCl (未配平),该反应配平后的化学方程式是(有机化合物均用结构简式表示):
化合物E(HOCH2CH2Cl)和 F [ HN(CH2CH3)2 ]是药品普鲁卡因合成的重要中间体,普鲁卡因的合成路线如下:(已知:  )
)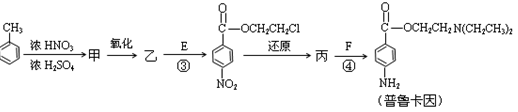
(4)甲的结构简式是 _________________。
由甲苯生成甲的反应类型是_________________。
(5)乙中有两种含氧官能团,反应③的化学方程式是
(6)丙中官能团的名称是 。
(7)普鲁卡因有两种水解产物丁和戊。
①戊与甲互为同分异构体,戊的结构简式是_____________________。
②戊经聚合反应制成的高分子纤维广泛用于通讯、宇航等领域。该聚合反应的化学方程式是 。
③ D的红外光谱表明分子内除C—H键、C—C键外还含有两个C—O单键。则D与F在一定条件下反应生成丁的化学方程式是________________________________。
(12分)以下是用硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2)为原料制备高纯氧化铁的生产流程示意图:

回答下列问题:
(1)酸浸、过滤后滤液A中的金属阳离子是______________________________。
(2)滤液B中加入NH4HCO3溶液的离子方程式。
(3)煅烧FeCO3生成产品I的化学反应方程式为_____________________________。
(4)已知几种盐的溶解度随温度变化的曲线如如图所示,产品Ⅱ的化学式为 ,为了获得产品Ⅱ,向(NH4)2SO4溶液中加入KCl溶液后,还需要进行的操作是 、趁热过滤、洗涤、干燥。
(5)检验产品Ⅱ晶体中是否含有少量的氯化物杂质需用到的试剂是_______________,进一步提纯产品Ⅱ的方法是________________;
(6)步骤Ⅲ中可选用______________(填序号)试剂调节溶液的pH。
| A.稀硝酸 | B.双氧水 | C.氨水 | D.高锰酸钾溶液 |
金属钒(V)在材料科学上有重要作用,被称为“合金的维生素”。以下是测定矿石中钒的含量的两个反应:
(1)用稀硫酸溶解五氧化二钒,得到(VO2)2SO4溶液。写出该反应的化学方程式
____________________________________________________________;
该反应______(选填“是”或“不是”)氧化还原反应。
(2)用已知浓度的硫酸酸化的H2C2O4溶液,滴定(VO2)2SO4溶液,完成下列离子方程式,方框内填数字,短线上填写物质的化学式或离子符号。
VO2+ +H2C2O4 + ______ →VO2+ +CO2 + ______
(3)当收集到标准状况下气体112毫升时,电子转移的数目为
(4)甲同学提出:上述反应能否用盐酸酸化?乙同学认为:要回答这个问题还得知道
A.VO2+和HCl氧化性相对强弱B.VO2+和Cl2氧化性相对强弱 C.上述均不正确.
(10分)某混合物的水溶液,可能含有以下离子中的若干种:K+、Al3+、Fe3+、Mg2+、Ba2+、NH4+、Cl-、CO32-、SO42-,现分别取100mL的两等份溶液进行如下实验:
①第一份加过量NaOH溶液后加热,收集到0.02mol气体,无沉淀生成,同时得到溶液甲。
②向甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧后,得到1.02g固体。
③第二份加足量BaCl2溶液后,生成白色沉淀,沉淀经足量盐酸洗涤、干燥后,得到11.65g固体。
依据实验回答下列问题:
(1)由①可知存在的离子为,浓度是mol·L-1;由②可知存在的离子为,浓度是mol·L-1;由③可知存在的离子为,浓度是mol·L-1。
(2)该溶液中一定不存在的离子是(填离子符号)。
(3)某同学通过分析认为该溶液中一定存在K+,他的理由是。
有一在空气中暴露过的KOH固体,经分析含H2O 2.8%,K2CO3 7.2%,取1g该样品投入25ml浓度为2mol/L的盐酸中,中和多余的盐酸又用去1.0mol/L的KOH溶液30.0ml,将中和后的溶液蒸干,所得固体的质量为
观察下列A、B、C、D、E五种粒子(原子或离子)的结构示意图,回答有关问题。
(1)上述离子中属于金属元素的是________(填元素符号),与非金属原子相对应的离子的结构示意图是______。
(2)电子层结构相同的是__________(填序号,下同),性质最稳定的是________,最容易失去电子的是________,最容易得到电子的是______________。
(3)可直接相互结合形成的化合物的化学式是__________,可经过得失电子后再相互结合形成的化合物的化学式是_____________。