已知X+、Y3+、Z-、W2-是短周期元素X、Y、Z、W形成的离子,下图中的甲、乙、丙均是由上述四种离子中的两种组成的化合物。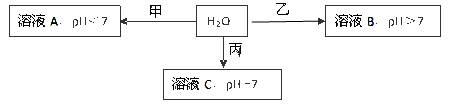
回答下列问题:
(1)通常状况下,Z的单质是一种黄绿色气体,工业上常用电解溶液C的方法制备该单质,制备反应的化学方程式是
(2)①甲的化学式是 ,乙的化学式可能是 (写一种即可)
②若W2-和Z-具有相同电子层结构,则乙的电子式是
(3)Y单质可用来制造Y—空气燃料电池,该电池通常以溶液C或氢氧化钾溶液为电解质溶液,通入空气的电极为正极。
①若以溶液C为电解质溶液时,正极的反应式为
②若以氢氧化钾溶液为电解质溶液时,电池的总反应式为
下图表示的反应关系中,部分产物被略去。已知2 mol白色固体粉末X受热分解,恢复到室温生成白色固体A、无色液体B、无色气体C各1 mol。X、E、G的焰色反应均为黄色。
回答下列问题:
(1)写出下列物质的化学式:X_____________G_____________D_____________;
(2)写 出G与过量的C反应生成D的离子方程式:;
出G与过量的C反应生成D的离子方程式:;
(3)写出X+E A的离子方程式:;
A的离子方程式:;
(4)C与Na2O2反应时,若消耗0.2 mol Na2O2则转移的电子数为_____________个。
“比较”是化学研究物质性质的基本方法之一,请运用比较法解答下列问题:已知在一定条件下,过氧化钠几乎可与所有的常见气态非金属氧化物反应。如:
2Na2O2+2CO2=2Na2CO3+O2 Na2O2+CO=Na2CO3
(1)试分别写出Na2O2与SO2、SO3反应的化学方程式。
,
;
(2)通过比较可知:在氧化物中,当非金属元素处于价时,其氧化物与过氧化钠反应就有O2生成。
请写出正确的方程式。
(1)除去Na2CO3粉末中混入的NaHCO3杂质,相应的化学方程式是________________ ___;
___;
(2)除去NaCl溶液中混入的少量NaHCO3杂质,相应的离子方程式是_________________;
(3)除去Fe2O3中混有的Al2O3,相应的离子方程式是;
(4)除去FeCl2溶液中混有的FeCl3,相应的离子方程式是。
A、B、C、D、E、G、H、I、J是中学化学常见的9种化合物,E、F、H常温下呈气态,其中F是人类生存不能离开的气态单质,B是常温下呈液态的含两种元素的化合物,化合物C中既含离子键又含非极性共价键,I为白色沉淀,反应③常用于焊接和切割金属,其转化关系如下图,据此回答下列问题: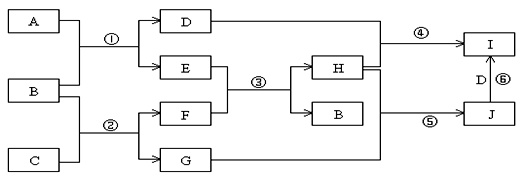
(1)写出反应①的化学方程式:;
(2)写出反应②的化学方程式:;
(3)列出两种E能发生的反应类型:(至少写两种)
(4)写出少量的H和D溶液反应的离子方程式:
近年来,我国储氢纳米碳管研究获重大进展,电弧法合成的碳纳米管,常伴有大量物质——碳纳米颗粒。这种碳纳米颗粒可用氧化气化法提纯。其反应的化学方程式为:
C+K2Cr2O7 +H2SO4(稀) 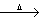 CO2↑+ K2SO4 + Cr2 (SO4 ) 3+ .
CO2↑+ K2SO4 + Cr2 (SO4 ) 3+ .
(1)完成并配平上述反应的化学方程式。
(2)此反应的氧化剂是,氧化产物是。
(3)H2SO4在上述反应中表现出来的性质是(填选项编号)
| A.酸性 | B.氧化性 | C.吸水性 | D.脱水性 |
(4)上述反应中若产生11g气体物质,则转移电子的数目为。