“比较”是化学研究物质性质的基本方法之一,请运用比较法解答下列问题:已知在一定条件下,过氧化钠几乎可与所有的常见气态非金属氧化物反应。如:
2Na2O2+2CO2=2Na2CO3+O2 Na2O2+CO=Na2CO3
(1)试分别写出Na2O2与SO2、SO3反应的化学方程式。
,
;
(2)通过比较可知:在氧化物中,当非金属元素处于 价时,其氧化物与过氧化钠反应就有O2生成。
(6分)石油通过裂化和裂解可以得到乙烯,乙烯的产量可以用来衡量一个国家石油化工发展水平。下图是由乙烯为原料生产某些化工产品的转化关系图。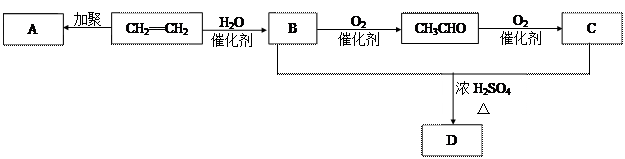
据此回答下列问题。
(1)写出乙烯的一种用途_______,指出乙烯→B的反应类型(选填取代反应或加成反应)。
(2)写出A的结构简式__________________。
(3)写出B + C → D的化学反应方程式___________________________________。
电解原理在化学工业中广泛的应用。如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题: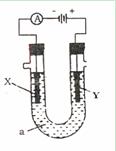
(1)若X、Y都是惰性电极,a是饱和CuSO4溶液,实验开始时,同时在两边各滴入石蕊试液,则①Y电极上的电极反应式为
②在Y电极附近观察到的现象是
(2)若X、Y都是铜电极,a是浓度均为2mol·L-1的AgNO3与Cu(NO3)2的混合溶液1L,电解一段时间后X电极上有12.8g铜析出,此时直流电源已输出mol电子。
(3)用石墨电极电解100mLH2SO4和CuSO4混合液,通电一段时间后,两极各出现气体3.36L(标准状况),求原来溶液中CuSO4的浓度。
请用学过的知识分析其中的化学原理并写出化学方程式,属于离子反应的请写出离子方程式。(1)将氯气通入熟石灰即可制的漂白粉【漂白粉的有效成分是次氯酸钙Ca(ClO)2,商品漂白粉往往含有Ca(OH)2等杂质】。(2)漂白粉之所以具有漂白作用是由于Ca(ClO)2在水溶液中发生水解反应生成具有强氧化性的物质。(3)Ca(OH)2杂质的存在使溶液的碱性增强,因此漂白作用进行缓慢。要在短时间受到漂白效果,必须除去Ca(OH)2,所以工业上使用漂白粉是常加入少量弱酸如醋酸等,或加入少量的稀盐酸、
。(4)家庭使用漂白粉不必加酸,因为水中的CO2也起到了弱酸的作用。(5)不要将漂白粉与洁厕剂等强酸性物质混合使用,因为在强酸性条件下二者可以发生氧化还原反应生成一种有毒气体:
水的电离平衡曲线如图所示。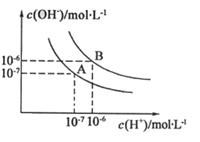
(1)若以A点表示25℃时水的电离平衡的离子浓度,当温度升高到100℃时,水的电离平衡状态移动到B点,则此时水的离子积从变化到。(2)将PH=8的Ba(OH)2溶液与PH=5的稀盐酸混合,并保持100℃的恒温,致使混合溶液的PH=7,则Ba(OH)2和盐酸的体积之比为。
(3)已知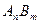 的离子积为
的离子积为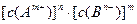 若某温度下
若某温度下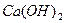 的溶解度为0.74g,设饱和溶液的密度为
的溶解度为0.74g,设饱和溶液的密度为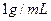 ,其离子积约为。
,其离子积约为。
(4)已知25℃时,0.1 L 0.1 mol·L-1的NaA溶液的pH = 10,则NaA溶液中所存在的离子的物质的量浓度由大到小的顺序为。
甲、乙两同学拟用实验确定某酸HA是弱电解质。他们的方案分别是:
甲:①称取一定质量的HA配制0.1 mol/L的溶液100 mL;
②用pH试纸测出该溶液的pH,即可证明HA是弱电解质。
乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制pH=1的两种酸溶液各100 mL;
②分别取这两种溶液各10 mL,加水稀释为100 mL;
③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都要用到的定量仪器是。
(2)甲方案中,说明HA是弱电质的理由是测得溶液的pH___1(选填>,<,=)。简要说明pH试纸的使用方法:
(3) 乙方案中,说明HA是弱电解质的现象是_________。
(4)请你再提出一个合理而比较容易进行的方案(药品可任取),作简明扼要表述。