(8分)研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)一定条件下,将2molNO与2molO2置于恒容密闭容器中发生反应2NO(g)+O2(g) 2NO2(g),下列各项能说明反应达到平衡状态的是 。
2NO2(g),下列各项能说明反应达到平衡状态的是 。
a.体系压强保持不变
b.混合气体颜色保持不变
c.NO和O2的物质的量之比保持不变
d.每消耗1 molO2同时生成2 molNO2
(2)CO可用于合成甲醇,一定温度下,向体积为2L的密闭容器中加入CO和H2,发生反应CO(g)+2H2(g) CH3OH(g),达平衡后测得各组分浓度如下:
CH3OH(g),达平衡后测得各组分浓度如下:
| 物质 |
CO |
H2 |
CH3OH |
| 浓度(mol•L—1) |
0.9 |
1.0 |
0.6 |
①列式并计算平衡常数K=__________________________。
②若降低温度,K值增大,则反应的△H 0(填“>”或“<”)。
③若保持体积不变,再充入0.6molCO和0.4molCH3OH,此时v正___v逆(填“>”、“<”或“=”)
近年来,酸雨污染较为严重,防治酸雨成了迫在眉睫的问题。
(1)火力发电厂为除去有害气体SO2,并变废为宝,常采用尾气脱硫工艺,如图所示。写出尾气脱硫工艺中反应的化学方程式:。
(2)宁波的火力发电厂通常建在海边,一般海水呈弱碱性,主要含有Na+、Mg2+、K+、Ca2+、Cl-、Br-、SO42-、HCO3-等离子。含有SO2的烟气也可以利用海水脱硫,其工艺流程如下图所示:
①向曝气池通入空气的目的是。
②通入空气后的曝气池中的海水与天然海水相比,浓度有明显不同的离子是。
| A.Cl- | B.Na+ | C.Mg2+ | D.HCO3- |
(3)有人提出了一种利用氯碱工业产品处理含二氧化硫废气的方法,将含SO2的废气通入电解饱和食盐水后所得到的NaOH溶液中,得NaHSO3溶液。写出得到NaHSO3溶液的离子方程式:。
A、B、C、D、E五种短周期元素,它们的原子序数依次增大。A是元素周期表中原子半径最小的元素,B元素原子L层上的电子数为K层电子数的2倍;元素D的2价阴离子的核外电子排布与氖原子相同;E与A同主族;A和E这两种元素与D都能形成X2Y、X2Y2型化合物。请回答:
(1)写出元素的符号:C;E 。
(2)化合物A2D的电子式为。
(3)元素B的一种同位素可测定文物年代,这种同位素的符号是。
(4)B的最高价氧化物的结构式。
(5)写出符合X2Y2的物质在MnO2催化作用下生成D单质的方程式。
(10分)有三份不同质量的铁粉样品①②③,甲、乙、丙三位同学各取一份样品分别与含有0.8molHNO3的稀硝酸反应,反应后硝酸和铁均无剩余,且硝酸的还原产物只有NO。据此回答下列问题:
(1)甲取样品①,反应后的溶液中铁只以Fe3+离子的形式存在,则样品①的质量为g。
(2)乙取样品②,反应后的溶液中既含有Fe3+、又含有Fe2+离子,则样品②的质量(设为ag)范围是。
(3)丙取样品③,将其慢慢加入到稀硝酸中,并不断搅拌,反应过程中溶液里Fe3+、Fe2+、NO3—三种离子中的两种离子的物质的量的变化曲线如下图所示,则该曲线表示的是物质的量变化的曲线,请你在此图中再画出另外种离子的物质的量的变化曲线。
某研究性学习小组为了测定某品牌合金中铝的含量,现设计了如下实验: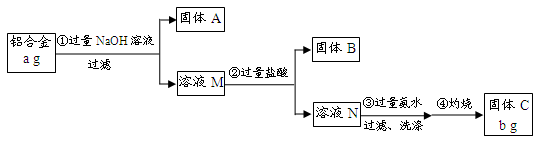
已知:(1)该铝合金的主要成分为铝、镁、铜、硅。
(2)常温下,硅能和NaOH发生反应:Si+2NaOH+H2O===Na2SiO3+2H2↑。
请回答下列问题:
(1)固体A的成分是;
(2)生成固体B的离子方程式为;
步骤③中生成沉淀的离子方程式为;
(3)检验步骤③中沉淀是否洗涤干净的实验操作为
;
(4)该样品中铝的质量分数是;(用a、b表示)
(5)下列因操作不当,会使测定结果偏大的是;
| A.第①步中加入NaOH溶液不足 | B.第②步中加入盐酸不足时 |
| C.第③步中沉淀未用蒸馏水洗涤 | D.第④步对沉淀灼烧不充分 |
下图表示各物质之间的转化关系。已知:常温下B、D、F、G、I、J是气体, F、G是空气中的主要成分,D是一种碱性气体。A中阴、阳离子个数比是1∶1, E是一种黑色氧化物,H是紫红色金属单质。(部分生成物和反应条件省略)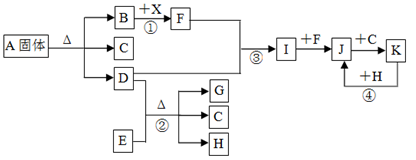
请按要求填空:
(1)A物质的化学式是;
(2)反应③的化学方程式是;
反应④的离子方程式是;
(3)反应①中产生标准状况下1.12L气体F,则转移的电子数目是;
(4)检验溶液A中阳离子的方法是
;
(5)反应②中氧化剂是;