实验室需要500ml 0.4m ol·L-1的NaOH溶液,配制时:
ol·L-1的NaOH溶液,配制时:
(1)称量NaOH固体时,固体应放在__________ 中置于天平的左盘称量。
(2)配制过程中,下列仪器中肯定不需要使用的是 。
(3)根据实验的实际需要和(2)中列出的仪器判断,完成实验还缺少的仪器是(填仪器名称)______________________________ 。
(4)若实验时遇到下列情况,所配溶液的浓度偏大的是 。
| A.加水定容时超过刻度线,又吸出少量水至刻度线 |
| B.忘记将洗涤液转入容量瓶 |
C.容量瓶洗涤后内壁有水珠而未作干燥处理 |
| D.溶液未冷却即转入容量瓶 |
E.定容时俯视刻度线
(8分)已知化学反应中的能量变化,是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同所致。下图为N2(g)和O2(g)生成NO(g)过程中的能量变化: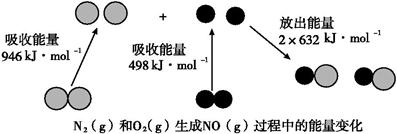
(1)人们通常把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,则N≡N键的键能为kJ·mol-1。根据上图写出N2(g)和O2(g)生成NO(g)的热化学方程式:。
(2)NO(g)分解生成N2(g)和O2(g)的热化学方程式为:。
当有16 g O2(g)生成时,该反应中放出的热量为:kJ。
(4分) 已知:
①P4(S,白磷)+5O2(g)= P4O10(S)△H = —2983.2kJ•mol-1
②P(S,红磷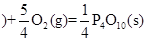 △H = —738.5kJ•mol-1
△H = —738.5kJ•mol-1
(1)写出白磷转化为红磷的热化学方程式:。
(2)则对应下列化学反应过程中的能量变化图,能正确反映出由白磷转化为红磷的是[选填A ~ D]。
天然气的主要成分甲烷燃烧生成二氧化碳和液态水的热化学方程式是:
CH4(g) + 2O2(g) == CO2(g) + 2H2O(l)ΔH="=" -889.6kJ/mol
请回答下列问题:
(1)反应物能量总和________(填“大于”、“小于”或“等于”)生成物能量总和。
(2)若1 mol甲烷完全燃烧生成二氧化碳和水蒸气,则放出的热量(填“>”、“<”或“=”)889.6kJ。
(3)已知氢气燃烧生成液态水的热化学方程式是:2H2(g)+O2(g) ===2H2O(l) ΔH =-572kJ/mol ,则相同质量的甲烷和氢气,完全燃烧生成液态水,放热较多的是________。
(4)如图所示的装置是由CH4、O2和KOH溶液组成的新型燃料电池,利用该装置可以将能转化为能。
用稀盐酸和氢氧化钡溶液进行酸碱中和反应实验,该反应过程中溶液酸碱度变化及相关数据如右图所示。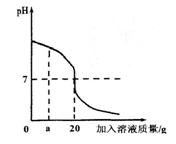
(1)根据此变化曲线,你认为实验操作是将滴加到另一种溶液中。
(2)当加入溶液质量是a g时,溶液中溶质是(写化学式)。
(3)若用pH试纸测定溶液的酸碱度,请写出测定方法:。
(4)当pH=7时,测得生成氯化钡的物质的量为0.05mol,求盐酸中溶质的质量分数?
右图中两圆相交部分(A、B、C、D)可表示铁、稀硫酸、烧碱溶液、硫酸铜溶液间的反应关系,请按下列要求填空:
(1)A处产生的现象是
(2)B处发生反应的类型是;
(3)C处发生反应的化学方程式是 ;
(4)D处发生反应的化学方程式是 。