(12分)某化学兴趣小组需100 mL某物质的量浓度的FeSO4溶液作标准试剂,现有外观颜色发黄的硫酸亚铁晶体、浓硫酸、稀盐酸、KMnO4溶液、溴水、KSCN溶液、石蕊、酚酞及中学化学常用化学仪器,实验过程如下:
Ⅰ.配制FeSO4溶液
(1)下列关于FeSO4溶液配制操作步骤的合理顺序为 。
A.在盛适量水的烧杯中滴加少量浓H2SO4后搅拌均匀并冷却到室温
B.称取一定质量的FeSO4晶体样品,放入烧杯内
C.将样品溶于已配制的稀H2SO4中,用玻璃棒搅拌至样品充分溶解
D.过滤后,将滤液转移到容量瓶中,加水稀释至指定刻度
E.往硫酸亚铁溶液中加入稍过量的铁粉,充分搅拌,静置一段时间至不再有气体冒出为止
(2)回答下列问题:
①将样品溶于稀H2SO4,而不直接溶于水的理由是 。
②上述配制过程中,除使用烧杯、量筒外,必不可少的玻璃仪器还有
Ⅱ.标定FeSO4溶液的浓度
(1)用移液管量取20.00 mL FeSO4溶液放入锥形瓶中,用0.1000 mol·L-1的酸性KMnO4溶液滴至终点,耗去KMnO4溶液20.00 mL,若生成物中Mn元素全部呈+2价,据此可测得FeSO4溶液的物质的量浓度为______。
(2)滴定时选用____ (A.石蕊B.酚酞C.不用指示剂,填序号)为指示剂,选用的理由是 。
海水中镁的总储量约为1.8×1015吨,而目前世界上利用的镁60%来自海水。如图是海水提取镁的工艺流程图。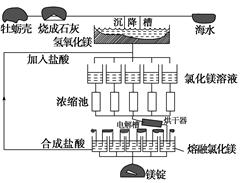
根据上面的图示,回答下列问题:
(1)请写出海水提取镁的工艺流程中属于分解反应的一个化学方程式:
________________________________________________________________________。
(2)工业上采用电解熔融MgCl2的方法制得金属镁,电解槽中阴极的电极反应式为:
________________________________________________________________________。
(3)上述制备镁的工艺流程中,适合循环经济的做法是
________________________________________________________________________。
(4)工业上制取金属铝时用电解__________(填原料)的方法,试解释铝电解槽中的阳极碳棒为何要定期更换?
________________________________________________________________________
________________________________________________________________________。
(1)据《科技消息报》报道:由于废气排放致使地球南极上空的a层出现了400多万平方公里的空洞,有害宇宙线长驱直入,把b分解,密度较小的氢就会逃逸到宇宙空间,剩下的氧最终会使土壤c,从而使地球人类正在重蹈火星的覆辙。根据以上叙述,回答问题。
①填充:a____b____c_____。
②写出a与b对应的化学方程式:a_________b________。
(2)据《中国环境报》报道:从一份科技攻关课题研究结果显示,我国酸雨区已占国土面积的40%。研究结果还表明,酸雨对我国农作物、森林等影响区域大。
如图是研究酸雨成因的学生实验用的“催化棒”。用两根外面套有玻璃管的粗导线穿过橡皮塞并固定于粗玻璃管中,在其中一端用电热丝连接起来,即制成“催化棒”。
实验时,先接通直流电源,使电热丝红热,然后将红热的电热丝伸入装有SO2和空气的集气瓶中,瓶中立即出现_____ 现象,再往其中加入盐酸酸化的氯化钡溶液,又出现______现象。
请回答:
①以上实验中可得出酸雨成因的化学原理是_________。
②目前一座中等城市每年用煤约300万吨,其含硫量如按1%计算,则每年排放SO2多少吨?若此二氧化硫有60%转化为硫酸,相当于生成多少吨98%硫酸?
③为了防治酸雨,降低煤燃烧时向大气排放的SO2,工业上将生石灰和含硫煤混合后使用。请写出燃烧时,有关“固硫”(不使硫的化合物进入大气)反应的化学方程式______,并比较此法与将“石灰石粉未与含硫煤混合”使用防治酸雨的方法,哪个更好些?答_________(填“生石灰法”或“石灰石法”)
④如每隔一段时间测定某份雨水(酸雨)样品的pH,请作出有关时间与酸雨pH变化的曲线图。
⑤国际上最新采用“饱和亚硫酸钠溶液吸收法”,请写出有关反应的化学方程式______。
硫酸最古老的生产方法是:把绿矾装入反应容器中加强热,会流出油状物,并放出有刺激性气味的气体,反应容器中的固体变为红色。这个变化过程可用两个化学方程式表示:,。
接触法制硫酸的原料是,生产过程的化学反应原理是:。
以下可逆反应中,达到平衡后,通过升高温度可提高反应物转化率的是;通过增大压强可提高反应物转化率的是;改变压强,转化率不变的是。
①A(s)+B(g)  C(g),ΔH < 0;
C(g),ΔH < 0;
②N2(g)+3H2(g)  2NH3(g), ΔH < 0;
2NH3(g), ΔH < 0;
③2NO2(g)  2NO(g) +O2(g),ΔH > 0;
2NO(g) +O2(g),ΔH > 0;
④2SO2(g)+O2(g)  2SO3(g) ,ΔH < 0。
2SO3(g) ,ΔH < 0。
⑤CO(g)+NO2(g)  CO2(g) +NO(g),ΔH < 0;
CO2(g) +NO(g),ΔH < 0;