(1)在298K时,1molCH4在氧气中完全燃烧生成二氧化碳和液态水,放出热量890.0 kJ。写出该反应的热化学方程式 。现有CH4和CO的混合气体0.75mol,完全燃烧后,生成CO2气体和18g液态水,并放出515kJ热量,则CH4的物质的量为 。
(2)利用该反应设计一个燃料电池:用氢氧化钾溶液作电解质溶液,多孔石墨做电极,在电极上分别通入甲烷和氧气。通入甲烷气体的电极应为 极(填写“正”或“负”),该电极上发生的电极反应式为 。
(3)在下图所示实验装置中总反应的方程式为 ;
如果起始时盛有1000mL pH=5的硫酸铜溶液(25℃,CuSO4足量),一段时间后溶液的pH变为1,此时可观察到的现象是 ;
若要使溶液恢复到起始浓度(温度不变,忽略溶液体积的变化),可向溶液中加入 (填物质名称),其质量约为 。
已知向FeCl3浓溶液中加入Na2CO3浓溶液,可以观察到产生红褐色沉淀和无色气体,写出该反应的离子方程式。
从形式上看,Na2SO3和Na2CO3相似,那么Na2SO3和FeCl3之间的反应情况又如何呢?某化学研究性学习小组提出了两种可能:一是发生氧化还原反应:2Fe3++SO32-+H2O=2Fe2++SO42-+2H+;二是发生双水解反应:2Fe3++3SO32-+6H2O=3Fe(OH)3(胶体)+3H2SO3; 为了弄清楚发生的是那一种反应发生,同学们设计并实施了下列实验,请填写下列空白:
实验Ⅰ:实验用品 Na2SO3浓溶液、BaCl2稀溶液、稀盐酸、试管若干、胶头滴管若干。从选择的药品分析,实验者设计这个实验的目的是。
实验Ⅱ:取5mLFeCl3浓溶液于试管中,逐滴加入Na2SO3浓溶液,观察到溶液的颜色由黄色变为红棕色,无气泡产生,无沉淀生成,继续加入Na2SO3浓溶液至过量,溶液的颜色加深,最终变为红褐色。这种红褐色物质是。向红褐色物质中逐滴加入稀盐酸至过量,可以观察的现象是。将溶液分成两等份,其中一份加入KSCN溶液,溶液变成血红色,反应的离子方程式为:。另一份加入BaCl2稀溶液,有少量白色沉淀生成,反应的离子方程式为:。
实验Ⅲ:换用稀FeCl3和Na2SO3溶液重复实验Ⅱ,产生的现象完全相同。
由上述试验得出的结论是。
下图表示各物质之间的转化关系。已知:A、D、F、H均为单质,X常温下为无色液体,B为淡黄色固体,J溶于酸得到黄色溶液。
请按要求填空:
(1)写出生成E的电极反应式,反应⑤的现象是。
(2)反应①的化学方程式是,在实验室中引发反应④的操作是。
(3)反应⑥中若转移1 mol e—,则被还原的X是mol。
(4)写出J与氢碘酸反应的离子方程式。
短周期元素形成的物质A、B、C、D、E,它们的转化关系如下图所示,物质A与物质B之间的反应不在溶液中进行(E可能与A、B两种物质中的某种相同) 。
。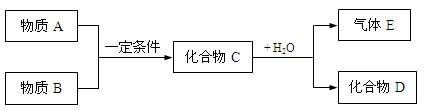
请回答下列问题:
(1)若C是离子化合物,D是一种强碱,写出C的电子式:____________________
(2)若E是有臭鸡蛋气味,D是既能溶于强酸,又能溶于强碱的化合物。
①用电离方程式解释D既能溶于强酸,又能溶于强碱的原因:
_________________________________________________________________________
②用等式表示E与NaOH溶液反应后生成正盐的溶液中所有离子浓度之间的关系:
_________________________________________________________________________
(3)若C是一种气体,D是一种强酸,且E与A相同,则C与水反应的化学方程式为(请标出电子转移方向和数目):
_________________________________________________________________________
(4)若A是一种单质,该元素的原子最外层电子数等于最内层,气体E能使湿润的红色石蕊试纸变蓝,那么化合物D是_____________。
在一定温度下,在容积不变的容器中通入2mol氮气和8mol氢气及固体催化剂,使之反应:N2(g)+3H2(g) 2NH3(g);△H="" -92.2KJ·mol-1,已知:平衡时容器内气体的压强为开始的80%.
2NH3(g);△H="" -92.2KJ·mol-1,已知:平衡时容器内气体的压强为开始的80%.
(1)平衡时容器内氨气的体积分数__
(2)反应达 到平衡状态时,放出的热量为
到平衡状态时,放出的热量为 __
__
A 小于92.2KJ B等于92.2KJ C 大于92.2KJ D 以上可能都存在
盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
①Fe2O3(s)+3CO(g)="=" 2Fe(s)+3CO2(g)△H= ―24.8kJ/mol
②3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g)△H= ―47.2kJ/mol
③Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H= +640.5kJ/mol
△H= +640.5kJ/mol
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式(要有推理过程)
__________________________