某兴趣小组的学生根据活泼金属Mg与CO2发生反应,推测活泼金属钠也能与CO2发生反应,因此兴趣小组用下列装置进行“钠与二氧化碳反应”的实验探究(尾气处理装置已略去)。已知:常温下,CO能使一些化合物中的金属离子还原
例如:PdCl2 + CO + H2O=Pd↓+ CO2 +2HCl 。反应生成黑色的金属钯,此反应也可用来检测微量CO的存在。

请回答下列问题:
(1)通常实验室制取CO2气体的离子方程式是 ,为了使制气装置能“随开随用,随关随停”,上图A处应选用的装置是___ (填写 “Ⅰ”、“Ⅱ”或“Ⅲ”)。若要制取干燥、纯净的CO2气体,装置B中应盛放的试剂是 溶液,装置C中应盛放的试剂是________ 。
(2)观察实验装置图可知Na与CO2反应的条件是_____________。检查装置的气密性完好并装入药品后,在点燃酒精喷灯前,必须进行的操作是____________________。待装置______(填写字母)中出现 现象时,再点燃酒精喷灯,这步操作的目的是 。
(3)假设CO2气体为足量,在实验过程中分别产生以下①、②两种不同情况,请分析并回答问题:
①若装置F中溶液无明显变化,装置D中生成两种固体物质,取少量固体生成物与盐酸反应后,有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式是 。
②若装置F中有黑色沉淀生成,装置D中只生成一种固体物质,取少量该固体与盐酸反应后,也有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式是 。
(4)请用文字简要说明你判断②中D装置生成固体的成分是钠的正盐或酸式盐的理由。 。
汽车已经成为重要的交通工具,但其排放的尾气是空气的主要污染物之一。已知汽车尾气中的主要污染物:CmHn(烃)、SO2、NOx、CO和C等,请回答下列有关问题:
(1)若用CmHn表示汽油的主要组成,CmHn在空气中完全燃烧的化学方程式为________________,汽油燃烧产生能量为汽车提供了动力,这一过程中能量的转化是由________能转化为________能,最终转化为机械能;
(2)通过车用燃油的精炼加工处理,可减少汽车尾气中的__________(填化学式,多填本空不得分)排放;
(3)目前汽车尾气多采用催化转化的方法加以治理,写出在催化剂作用下NOX与CO反应的化学方程式________。
全球海水中的溴的藏量丰富,约占地球溴的总藏量的99%,故溴有“海洋元素”之称。海水中溴含量为65mg/L。其工业提取方法有:
(1)空气吹出纯碱吸收法.方法是将氯气通入到富含溴离子的海水中,使溴置换出来,再用空气将溴吹出,用纯碱溶液吸收,最后用硫酸酸化,即可得到溴单质.该方法涉及到的反应有:
①________________写出离子方程式);
②Br2+3CO32-=BrO3-+5Br-+3CO2↑;
③BrO3-+5Br-+6H+=3Br2+3H2O。
其中反应②中的氧化剂是___________;还原剂是_________;
(2)空气吹出SO2吸收法.该方法基本同(1),只是将溴吹出后是用SO2来吸收的,使溴转化为氢溴酸,然后再用氯气氧化氢溴酸即得单质溴.写出溴与二氧化硫反应的化学方程式:___________;
(3)溶剂萃取法.该法是利用单质溴在水中和溶剂中溶解度的不同的原理来进行的.实验室中萃取用到的实验仪器名称是_________;下列可以用于海水中溴的萃取试剂的是_______;
①乙醇②四氯化碳③硝酸④裂化汽油
(1)为检验某溶液中是否含有SO42-离子,需加入两种试剂,其最佳操作顺序为:
①先加入______(填化学式),现象_____________________________
②后加入______(填化学式),现象_____________________________
结论:该溶液中一定含有SO42-离子
(2)某KNO3溶液中含有少量K2SO4,为完全除去SO42-得到纯净的KNO3溶液,所需试剂为________、_____、_____(按所加顺序填化学式)。
从氧化还原反应的角度看,在制备下列三种气体时,盐酸起什么作用:(填序号)
(1)制备H2 Zn+2HCl=ZnCl2+H2↑盐酸起______作用
(2)制备Cl2 MnO2+4HCl =MnCl2 +Cl2↑+2H2O盐酸起______作用
(3)制备CO2 CaCO3+2HCl=CaCl2+CO2↑+H2O盐酸起______作用
| A.氧化剂 | B.还原剂 |
| C.既是氧化剂又是还原剂 | D.既不是氧化剂也不是还原剂 |
(1)在Cu+2H2SO4(浓)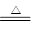 CuSO4+SO2↑+2H2O反应中,请用双线桥法标出元素化合价的升降、电子得失和被氧化、被还原的情况。
CuSO4+SO2↑+2H2O反应中,请用双线桥法标出元素化合价的升降、电子得失和被氧化、被还原的情况。
(2)维生素C能使食物中的Fe3+转化为Fe2+,即Fe3+ Fe2+
Fe2+
①在此变化中,Fe3+被_______(填氧化或还原,下同);维生素C是_______剂
②若有1molFe3+转化为Fe2+,则维生素C______(填得或失)_______mol电子