如下图的转化关系中,已知A是由短周期元素组成的酸式盐。D、Y、H为气体,X为无色液体,G和K均是常见的强酸。H与Na2O2可发生化合反应,生成的盐与Ba2+反应可生成不溶于稀G的白色沉淀,一个D分子中含有10个电子。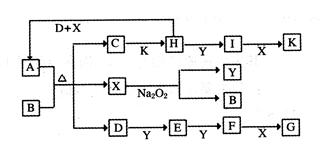
试回答下列问题:
(1)D的电子式为:___________________;
(2)写出D+H+X→A的化学方程式:________________________________;
(3)写出C→H的离子方程式:_______________________________;
(4)写出D与K反应生成的正盐的化学式:_____________;
(5)已知1molH(g)完全转化为I(g)时放热98.3kJ,则此反应的热化学方程式为____________________________;某条件下,当加入4 mol H和2 mol Y后,放出314.56 kJ的热时,此时H的转化率为__________;
(6)一定温度下,有可逆反应:aD(g)+bY(g) cE(g)+dX(g)。在2 L密闭容器中,充入4 mol D和5 mol Y,有催化剂存在下,2 min后反应达到平衡,测得平衡时容器内的压强比反应前增加了1/18。则前2 min内用E表示的平均反应速率为______mol·L-1·min-1,平衡时D的浓度为________mol·L-1。
cE(g)+dX(g)。在2 L密闭容器中,充入4 mol D和5 mol Y,有催化剂存在下,2 min后反应达到平衡,测得平衡时容器内的压强比反应前增加了1/18。则前2 min内用E表示的平均反应速率为______mol·L-1·min-1,平衡时D的浓度为________mol·L-1。
(1)在101kPa下,CH4(g)、H2(g)、C(s)的燃烧热分别为890.3kJ•mo1—1、285.8kJ•mo1—1和393.5kJ•mo1—1,则反应C(s)+2H2(g)=CH4(g)的反应热ΔH=。
(2)已知:2H2(g)+O2(g)=2H2O(g) ΔH1
2H2(g)+O2(g)=2H2O(l) ΔH2
2CO(g)+O2(g)=2CO2(g) ΔH3
①液态水转化为气态水的热化学方程式为。
②CO和H2分别燃烧生成CO2 (g)和H2O(g),欲得到相同热量,所需CO和H2的体积比是。
某化工厂的含镍废催化剂主要含Ni,还含有Al、Al2O3、Fe、FeO、Fe2O3及其他不溶杂质(其他不溶杂质不与酸碱反应)。某校化学研究性学习小组设计了如下图所示的方法,以该含镍废催化剂为原料来制备NiSO4·7H2O。
【查阅资料】
①Ni能与非氧化性酸反应生成Ni2+,不与碱液反应。
②部分阳离子以氢氧化物形式沉淀时pH如下:
| 沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Ni(OH)2 |
| 开始沉淀的pH |
4.1 |
1.7 |
7.6 |
7.0 |
| 完全沉淀的pH |
5.2 |
3.2 |
9.5 |
9.2 |
回答下列问题:
(1)操作a为。
(2)“碱浸”的目的是除去(填化学式)。
(3)操作b为调节溶液的pH,你认为pH的最佳调控范围是。
(4)NiSO4在强碱溶液中用次氯酸钠氧化,可以制得碱性镍氢电池电极材料NiOOH。
①写出该反应的离子方程式。
②已知碱性镍氢电池总反应: H2+2NiOOH 2Ni(OH)2,写出该反应放电时正极反应式。
2Ni(OH)2,写出该反应放电时正极反应式。
(5)一般认为残留在溶液中的离子浓度小于1.0×10-5 mol·L-1时,沉淀已经完全。请利用上表中数据估算Fe(OH)2的溶度积 。
。
在体积固定的密闭容器中,进行如下化学反应:N2O4(g) 2NO2(g),其化学平衡常数K和温度t的关系如下表:
2NO2(g),其化学平衡常数K和温度t的关系如下表:
| t /℃ |
80 |
100 |
120 |
| K |
1.80 |
2.76 |
3.45 |
请回答下列问题:
(1)该反应的化学平衡常数表达式K=。
(2)该反应为反应(填“吸热”或“放热”)。
(3)判断该反应达到化学平衡状态的依据是。
A.容器内混合气体密度不变
B.混合气体中c(NO2)不变
C.0.5mol N2O4分解的同时有1 mol NO2生成
(4)在80℃时,将2.80molN2O4气体充入2L固定容积的密闭容器中,一段时间后对该容器内的物质进行分析,得到如下数据:
  |
0 |
20 |
40 |
60 |
80 |
100 |
| n(N2O4) |
2.80 |
A |
2.00 |
c |
d |
1.60 |
| n(NO2) |
0 |
0.96 |
b |
2.08 |
2.40 |
2.40 |
①b的值为;
②N2O4的平衡转化率为;
③20s~40s内用N2O4表示的平均反应速率υ(N2O4)=。
应用化学反应原理知识解决下列问题
(1)某温度下纯水中c (H+) = 2.0×10-7 mol·L-1,则此纯水中的c (OH-) =。
(2)将某CH3COOH溶液稀释10倍,则稀释后的溶液中c(H+)原来的十分之一(填“大于”、“小于”或“等于”)。
(3)0.1 mol·L-1的下列溶液①HCl、②CH3COOH、③CH3COONa、④FeCl3、⑤NaOH,其中pH最大的是(填序号);实验室配制的氯化铁溶液显弱酸性的原因:(用离子方程式表示)。
(4)一定条件下22g二氧化碳气体与足量氢气反应生成气态甲醇(CH3OH)和水蒸气时,放出247.5kJ热量,其反应的热化学方程式为。
浩瀚的海洋是一个巨大的宝库,蕴含有80多种元素,可供提取利用的有50多种。
(1)其中“氯碱工业”就是以食盐水为原料制取Cl2等物质,有关的化学方程式为:。
(2)实验室用二氧化锰制取氯气的化学方程式为:;根据上述实验原理,从下列装置中选择合适的发生装置用于实验室制取少量氯气(填写装置的序号)。
(3)实验室中模拟Br—→Br2的转化,可以通过在KBr溶液中滴加少量新制氯水的实验进行实现。写出Br—→Br2的转化离子方程式为:;氯水不稳定,要现用现配,下列吸收氯气制备氯水的装置最合理的是(选填下列选项的编号字母)。
(4)实验室制备氯气的反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学进行了以下实验:取100 mL残余液放入烧杯中,将烧杯(含玻璃棒)放在电子天平上(如右图),再把已称好50.0 g CaCO3粉末慢慢加入到残余液中,边加边搅拌使其充分反应。观察读数变化如下表所示:
| CaCO3用量 |
未加CaCO3时 |
加约四分之一时 |
加一半时 |
全部加完时 |
| 读数/g |
318.3 |
325.3 |
334.5 |
359.5 |
请你据此分析计算:
①实验中产生的CO2气体质量为;
②残余液中盐酸的物质的量浓度为 (结果精确到小数点后一位)。