某课外活动小组同学用下图装置进行实验,试回答下列问题: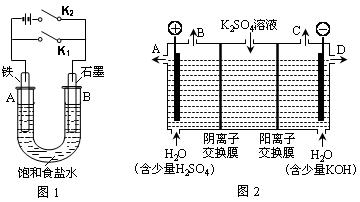
Ⅰ.以图1的实验装置进行实验。
(1)若开始时打开开关K2,闭合开关K1,则该装置为 (填装置名称)。
(2)若开始时打开开关K1,闭合开关K2,则:
四校2010届高三毕业班期末联考化学试卷 第7页 (共12页)
①U型管里总反应的离子方程式为 
②对于上述实验,下列说法正确的是 (填序号)。
| A.溶液中Na+向B极移动 |
| B.从A极处逸出的气体能使湿润的KI淀粉试纸变蓝 |
| C.反应一段时间后加适量盐酸可恢复到电解前电解质的浓度 |
| D.若标准状况下从A极逸出2.24L气体,则外电路上通过的电子数目略大于0.2NA |
Ⅱ.以图2的实验装置进行实验。
(3)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图2装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾(电解槽内的阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过)。
①该电解槽的阳极反应式为 。此时通过阴离子交换膜的离子数 (填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口 (填“A”、“B”、“C”、“D”)导出。
③通电开始后,阴极附近溶液的pH会增大,请简述原因 。
已知MOH为一元弱碱,25℃时,电离常数Kb= 1×10- 6mol·L-1,
(1)25℃时,将0.2 mol·L-1 HCl溶液与0.2 mol·L-1 MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,此时混合溶液中由水电离出的c(H+)=Amol·L-1,若0.2 mol/L HCl溶液中由水电离出的c(H+)=Bmol·L-1,则:
①比较AB。(填“>”、“<”或“=”)
②根据电荷守恒,计算混合溶液中c(Cl-)-c(M+)=______ mol·L-1。 (精确计算,填具体数字)
(2)25℃时,0.01 mol·L-1MOH溶液的 pH=10,将其与等体积 pH = 4的盐酸溶液混合,则混合溶液的pH 7(填“>”、“<”或“=”),试求此时溶液中M Cl的水解平衡常数Kh=mol/L
有下列物质①Cu;②液态SO2;③CH3COOH;④NaHCO3;⑤Ba(OH)2溶液;⑥熔融NaCl;⑦稀氨水;⑧BaSO4;⑨H2O
(1)属于强电解质的是(填序号) 属于弱电解质的是(填序号)
(2)常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中Na+、HCO3―、CO32―、OH―四种微粒的浓度由大到小的顺序为:。NaHCO3水解的离子方程式。
(3)Ba(OH)2是一种强电解质,现有25℃、pH=13的Ba(OH)2溶液。
①该Ba(OH)2溶液的物质的量浓度为___________________;
②与某浓度盐酸溶液按体积比(碱与酸之比)1 :9混合后,所得溶液pH=11(假设混合溶液的体积等于混合前两溶液的体积和),该盐酸溶液的pH=____________。
工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
CO ( g ) + 2H2 ( g )  CH3OH ( g )△H=-116kJ/mol
CH3OH ( g )△H=-116kJ/mol
(1)该反应的化学平衡常数表达式为;
(2)下列措施中有利于增大该反应的反应速率且提高转化率的是(填字母序号) 。
a.随时将CH3OH与反应混合物分离 b.降低反应温度
c.使用高效催化剂 d.增大体系压强
(3)一定条件下,将1 mol CO与3 mol H2的混合气体在催化剂作用下发生反应生成甲醇,平衡后将容器的容积压缩到原来的l/2,其他条件不变,对平衡体系产生的影响是(填字母序号).
a.c ( H2 )减少 b.正反应速率加快,逆反应速率减慢
c.CH3OH 的物质的量增加 d.重新平衡c ( H2 )/ c (CH3OH )减小
(4) 在密闭容器中充有1mol CO与2 mol H2,在催化剂作用下反应生成甲醇,CO的转化率(α)与温度(T)、压强(P)的关系如图所示。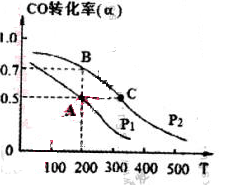
①A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间,tAtC(填“大于”、“小于’’或“等于")。
②若A点时容器的体积为1 L,该温度下B点的平衡常数 K= 。
现有反应:mA(g)+ B(g) 2C(g),达到平衡后,当升高温度时,A的转化率变小;当减小压强时,混合体系中C的质量分数不变,则:
2C(g),达到平衡后,当升高温度时,A的转化率变小;当减小压强时,混合体系中C的质量分数不变,则:
(1)该反应的△H0(填“>”或“<”),且m1(填“>”“=”“<”)。
(2)若加入B(假设容器的体积不变),则A的转化率,B的转化率。 (填“增大”“减小”或“不变”)
(3)若B是有色物质,A、C均无色,则加入C(假设容器的体积不变)时混合物颜色,而维持容器内压强不变,充入氖气时,混合物颜色(填“变深”“变浅”或“不变”)。
(4)一定温度下,向1L密闭容器中加入1mol C(g)使其分解,气体A的物质的量随时间的变化如下图所示。则0~2 min内的平均反应速率υ(C)=。
I.(1)向Ba(OH)2溶液中加入稀硫酸,请完成下列问题:
(1)写出反应的离子方程式:________________________________。
(2)下列三种情况下,离子方程式与(1)相同的是_________________。
A.向NaHSO4溶液中逐滴加入Ba(0H)2溶液至显中性
B.向NaHSO4溶液中逐滴加入Ba(0H)2溶液至SO42-恰好完全沉淀
C.向NaHSO4溶液中逐滴加入Ba(0H)2溶液至过量
Ⅱ.实验室可以用氯酸钾和浓盐酸反应制取氯气,反应式如下:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O
(1)用双线桥法表示上述反应中电子转移的方向和数目。
(2)反应中发生氧化反应的物质是____________(填化学式),被还原的元素是____________________(填元素名称)。
(3)氧化剂与还原剂的物质的量之比为____________________。
(4)若反应中被氧化的盐酸为1mol,则生成的氯气体积为_______________(标准状况下)。