t℃时,将3 mol A 和1 mol B气体,通入体积为2L的密闭容器(容积不变),发生反应:3A(g) + B(g)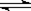 4 C(g) 2min时反应达到平衡状态(温度不变),并测得C 的浓度为0.4 mol/L,请填写下列空白:
4 C(g) 2min时反应达到平衡状态(温度不变),并测得C 的浓度为0.4 mol/L,请填写下列空白:
(1)从反应开始到达到平衡状态,生成C的平均反应速率为_______________________。
(2)达到平衡状态时,B 物质的转化率α(B) = _____________,
平衡常数K= _____________________(填计算结果)。
(3)若继续向原混和物质通入少量氦气后(设氦气不与A、B、C反应),化学平衡__________(填字母)
A、向正反应方向移动 B、向逆反应方向移动 C、平衡不移动。
某可逆反应从0—2分钟进行过程中,在不同反应时间各物质的量的变化情况如图
所示。
⑴则该反应的的反应物,生成物是,化学方程式为;
⑵能否计算反应开始至2分钟时,用C表示的反应速率?若能,其反应速率为,
若不能,则其原因为 __;
⑶2分钟后A、B、C各物质的量不再随时间的变化而变化,说明在这个条件下,反应已达到了_________状态。
(9分) W.X.Y.Z是原子序数依次增大的同一短同期元素,W.X是金属元素,Y.Z是非金属元素。
(1)W.X各自的最高价氧化物对应的水化物可以反应生盐和水,该反应的离子方程式为________________。
(2)W与Y 可形成化合物W2Y,该化合物为 (填离子化合物或共价化合物)
(3)Y的低价氧化物通入Z单质的水溶液中,发生反应的离子方程式为___________。
(4)比较Y.Z气态氢化物的稳定性>(用化学式表示)
(5)W.X.Y.Z四种元素简单离子的离子半径由大到小的顺序是:
>>>。(用化学式表示)
(6)Z的最高价氧化物为无色液体,该物质与一定量水混合得到一种稀溶液,试写出该反应的化学方程式:_______________________。
现有如下两个反应:(A)NaOH + HCl =" NaCl" + H2O
(B)2FeCl3 + Cu = 2FeCl2 + CuCl2
(1)根据两反应本质,判断能否设计成原电池A:, B:______(填“能”与“不能”)
如果不能,说明其原因
(2)根据能设计成原电池的反应选择适宜的材料和试剂设计一个原电池:
①负极材料是, 正极材料是_______,电解质溶液是;
②写出正极的电极反应式,正极发生反应(填“氧化”或“还原”),
③若导线上转移电子0.1mol,则负极质量变化克。
除去下列物质中的杂质,根据要求填空:
| 物质 |
杂质 |
选用试剂 |
离子方程式 |
| FeCl2溶液 |
FeCl3 |
||
| SiO2 |
Al 2O3 |
||
| Fe2O3 |
Al 2O3 |
按要求用合适的化学用语填空
Ⅰ.在原子序数1—18号元素中:
(1)与水反应最剧烈的金属是_____________。
(2)与水反应最剧烈的非金属单质是_____________。
(3)原子半径最小的元素是_____________。
(4)气态氢化物最稳定的化学式是_____________。
(5)电子数为10的分子(写5个)
Ⅱ.下列各分子中,所有原子都满足最外层为8电子结构的是
①. H2O②. BF3③.CCl4④. PCl3⑤. SO3⑥. N2⑦. CO2