在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间(s) c(mol/L) |
0 |
20 |
40 |
60 |
80 |
100 |
| c(N2O4) |
0.20 |
a |
0.10 |
c |
d |
e |
| c(NO2) |
0.00 |
0.12 |
b |
0.22 |
0.22 |
0.22 |
反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅。
(1)该反应的化学方程式为 ,表中b c(填“<”、“=”、“>”)。
(2)20s时,N2O4的的浓度为 mol/L,0~20s内N2O4的平均反应速率为 。
(3)该反应的平衡常数表达式K= ,在80℃时该反应的平衡常数K值为 (保留2位小数)。
(4)在其他条件相同时,该反应的K值越大,表明建立平衡时 。
A、N2O4的转化率越高 B、NO2的产量越大
C、N2O4与NO2的浓度之比越大 D、正反应进行的程度越大
短周期主族元素A、B、C、D的原子序数依次增大,A与D同主族,B与C在同一周期,B原子最外层电子数比C原子少2个, A、C单质在常温下均为气体,它们在一定条件下以体积比2∶1完全反应,生成物在常温下是液体。此液体与D单质在常温下能剧烈反应生成A的单质。所得溶液滴入酚酞显红色。回答下列问题:
⑴写出元素符号A,B,C,D。
⑵写出B与C两种单质完全反应后所得生成物的电子式,该分子空间构型为。
⑶ C、D两种单质在点燃条件下形成的化合物的电子式,判断其中的化学键的类型。
⑷写出两种由A、B、C、D四种元素组成的化合物的化学式、。
(10分)填空:(填编号)
A.  Li Li  |
B. N N  |
C. Na Na |
D. M M g E. g E. Li F. Li F. C G.C60 H .CH3CH2COOH I.HO-CH2CH2-CHO J.金刚石 K. P4L.SiO2 M.NH4Cl C G.C60 H .CH3CH2COOH I.HO-CH2CH2-CHO J.金刚石 K. P4L.SiO2 M.NH4Cl |
(1)和互为同位素;
(2)中子数相等,但不是同一种元素的是和;
(3)和互为同素异形体, 和互为同分异构体。
和互为同分异构体。
(4)熔化时需要破坏共价键的是;晶体中既有离子键又有共价键的是。
﹙15分﹚已知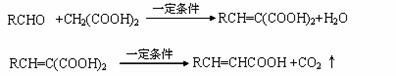
A与芳香族化合物B在一定条件下反生成C,进一步反应生成抗氧化剂阿魏酸(见下图)
A的相对分子质量是104,1molA与足量NaHCO3溶液反应生成2mol气体。
(1)A的结构简式是________________。
(2)在中学学过知识里 B不可能发生的反应是________ (填序号)
a、取代反应 b、加成反应c、氧化反应d、还原反应e、水解反应 f、显色反应
(3)等物质的量C分别与足量的Na、浓溴水、NaOH、NaHCO3反应时消耗Na、Br2、NaOH、NaHCO3的物质的量之比是
( 4)写出C与足量的Na2CO3的化学方程式为:
4)写出C与足量的Na2CO3的化学方程式为:
(5)写出符合下列条件的阿魏酸的一种同分异构体的结构简式:。
①在苯环上只有两个取代基;
②在苯环上的一氯取代物只有两种;
③1mol该同分异构体与足量NaHCO3反应生成2mol CO 2气体;
2气体;
(6)写出利用阿魏酸在一定条件下生成抗氧化性的高分子化合物的方程式:
___________________________________________________________________。
﹙14分﹚A为只含有C、H、O三种元素的芳香烃衍生物,各物质间的相互转化关系如下图。已知:ROH+HX RX+H2O;E为加聚得到的高分子化合物,
RX+H2O;E为加聚得到的高分子化合物, 分子式为(C9H8O2)n;I中除含有一个苯环外还含有一个六元环,分子式为C9H8O2;H分子式为C18H16O6。
分子式为(C9H8O2)n;I中除含有一个苯环外还含有一个六元环,分子式为C9H8O2;H分子式为C18H16O6。
(1)写出A、E、I的结构简式:A;E;I。
(2)B→C的反应条件为____________________。
(3)A+G→H的反应类型为。
(4)有机物A的同分异构体只有两个对位取代基,既能与Fe3+发生显色反应,又能发生水解反应,但不能发生银镜反应。则此类A的同分异构体有4种 。例如:
。例如: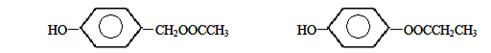
请写出另两种同分异构体
﹙15分﹚(1)具有明显现象的官能团特征反应常被用来鉴定化合物。
①欲区分CH2 =CH2和CH3 CH3 ,应选用 __ (填字母)。
a.NaOH溶液 b.溴水 c.银氨溶液
②欲区分HCHO和HCOOH,应选用 _(填字母)。
a.KMnO4溶液 b.银氨溶液 c.Na2CO3溶液
③欲区分 和
和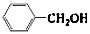 ,应选用 ___ (填字母)。
,应选用 ___ (填字母)。
a.FeCl3溶液 b.NaOH溶液 c.AgNO3溶液
(2)在有机化学中,同分异构是普遍存在的现象。分子式为C4H9OH的有机物共有
种。其中,一种有机物通过消去反应可转变为2-丁烯,请写出该消去反应的化学方程式:;另一种有机物不能发生催化氧化,请写出该有机物的结构简式: 。
。
(3)A是石油裂解气的成分之一,A的某一同系物E的产量通常用来衡量一个国家的石油化工水平。现以A为主要原料合成C6H12O2,其合成路线如下图所示:
回答下列问题:
①A的结构简式为:______ ________。
________。
②B、D分子中的官能团名称分别为_______________、_____________。
③写出B的同类别的同分异构体的结构简式:___________________。
④写出B→C的化学方程式:_______________________ __________________。
__________________。