﹙15分﹚已知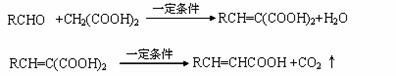
A与芳香族化合物B在一定条件下反生成C,进一步反应生成抗氧化剂阿魏酸(见下图)
A的相对分子质量是104,1molA与足量NaHCO3溶液反应生成2mol气体。
(1)A的结构简式是________________。
(2)在中学学过知识里 B不可能发生的反应是________ (填序号)
a、取代反应 b、加成反应c、氧化反应d、还原反应e、水解反应 f、显色反应
(3)等物质的量C分别与足量的Na、浓溴水、NaOH、NaHCO3反应时消耗Na、Br2、NaOH、NaHCO3的物质的量之比是
( 4)写出C与足量的Na2CO3的化学方程式为:
4)写出C与足量的Na2CO3的化学方程式为:
(5)写出符合下列条件的阿魏酸的一种同分异构体的结构简式: 。
①在苯环上只有两个取代基;
②在苯环上的一氯取代物只有两种;
③1mol该同分异构体与足量NaHCO3反应生成2mol CO 2气体;
2气体;
(6)写出利用阿魏酸在一定条件下生成抗氧化性的高分子化合物的方程式:
___________________________________________________________________。
某天然碱的化学组成为aNa2CO3·bNaHCO3·cH2O(a、b、c为正整数),下面是利用天然碱制备小苏打和烧碱的流程图。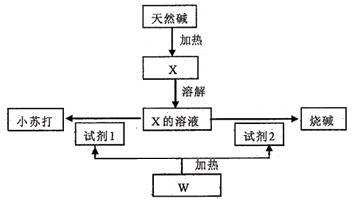
回答下列问题:
(1)向X的溶液中滴入酚酞试液后溶液显色,原因是(写离子方程式)
。向上述溶液中滴人过量的CaCl2溶液,观察到的现象是。
(2)上述由X制备小苏打和烧碱的化学方程式:。
(3)若取3 32g天然碱样品充分加热收集到0.112L(标况)CO2和0.45g H2O,将所得固体于足量稀盐酸中又收集到0.56L(标况)CO2气体,试推算该天然碱的化学组成。
(16分)氨气是一种重要的基础化工原料,用途广泛。
在微电子工业中,氨水可作刻蚀剂H2O2的清除剂,产物不污染环境。该反应的化学方程式为2NH3+3H2O2=+6H2O
工业中常用以下反应合成氨:N2+3H2 2NH3△H<0。某实验室在三个不同条件的密闭容器中,分别加入浓度均为C(N2)="0.100mol/L," C(H2)=0.300mol/L进行反应时, N2的浓度随时间的变化如下图①、②、③曲线所示。
2NH3△H<0。某实验室在三个不同条件的密闭容器中,分别加入浓度均为C(N2)="0.100mol/L," C(H2)=0.300mol/L进行反应时, N2的浓度随时间的变化如下图①、②、③曲线所示。
(1)该反应平衡常数的数学表达式;实验②平衡时H2的转化率为_______
(2)据图所示,②、③两装置中各有一个条件与①不同。请指出,并说明判断的理由。
②条件:_______理由:________
③条件:_______理由:________
(一)糖类、油脂、蛋白质都是人体必需的营养物质。
(1)油脂被摄入人体后,在酶的作用下水解为高级脂肪酸和_____________(写名称),进而被氧化生成二氧化碳和水并提供能量,或作为合成人体所需其他物质的原料。
(2)氨基酸是组成蛋白质的基本结构单元,其分子中一定含有的官能团是氨基(—NH2)和____________(写结构简式或名称)。
(3)淀粉在淀粉酶的作用下最终水解为葡萄糖(C6H12O6),部分葡萄糖在体内被氧化生成二氧化碳和水。写出葡萄糖在体内被氧化的化学方程式:________________________。
(二)茉莉花香气的成分有多种,乙酸苯甲酯(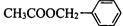 )是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成。一种合成路线如下:
)是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成。一种合成路线如下: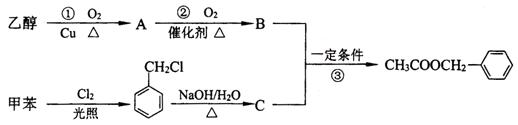
(1)C的结构简式为_______________。
(2)写出反应①的化学方程式:______________ __________。
(3)反应③的反应类型为_____________________________。
(4)反应______ ____(填序号)原子的理论利用率为100%,符合绿色化学的要求。
四川攀枝花蕴藏丰富的钒、钛、铁资源。用钛铁矿渣(主要成分为TiO2、FeO、Fe2O3,Ti的最高化合价为+4)作原料,生产白色颜料二氧化钛的主要步骤如下:


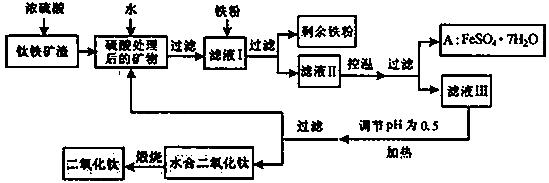
请回答下列问题:


(1)硫酸与二氧化钛反应的化学方程式是____________________________________。
(2)向滤液I中加入铁粉,发生反应的离子方程式为:_________________________、_______________________________________。
(3)在实际生产过程中,向沸水中加入滤液Ⅲ,使混合液pH达0.5,钛盐开始水解。水解过程中不断通入高温水蒸气,维持溶液沸腾一段时间,钛盐充分水解析出水合二氧化钛沉淀。请用所学化学平衡原理分析通入高温水蒸气的作用:_______________________________________________。
过滤分离出水合二氧化钛沉淀后,将滤液返回的主要目的是充分利用滤液中的钛盐、___________、______________、_______________________(填化学式),减少废物排放。
(4)A可用于生产红色颜料(Fe2O3),其方法是:将556a kgA(摩尔质量为278 g/mol)溶于水中,加入适量氢氧化钠溶液恰好完全反应,鼓入足量空气搅拌,产生红褐色胶体;再向红褐色胶体中加入3336b kg A和112c kg铁粉,鼓入足量空气搅拌,反应完成后,有大量Fe2O3附着在胶体粒子上以沉淀形式析出;过滤后,沉淀经高温灼烧得红色颜料。若所得滤液中溶质只有硫酸钠和硫酸铁,则理论上可生产红色颜料_______________________kg。
接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行: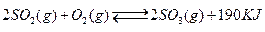
1)该反应所用的催化剂是___(填写化合物名称),该反应450℃时的平衡常数 _____500℃时的平衡常数(填“大于”、“小于”或“等于”)。
2)该热化学反应方程式的意义是____________
a.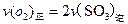 b.容器中气体的平均分子量不随时间而变化
b.容器中气体的平均分子量不随时间而变化
C.容器中气体的密度不随时间而变化d.容器中气体的分子总数不随时间而变化
4)在一个固定容积为5L的密闭容器中充入0.20 mol 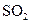 和0.10mol
和0.10mol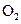 ,半分钟后达到平衡,测得容器中含
,半分钟后达到平衡,测得容器中含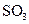 0.18mol,则
0.18mol,则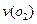 =______
=______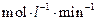 :若继续通入0.20mol
:若继续通入0.20mol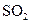 和0.10mol
和0.10mol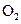 ,则平衡______移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,______ mol<n(
,则平衡______移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,______ mol<n(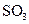 )<______mol。
)<______mol。