运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应N2(g)+3H2(g) 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡 移动(填“向左”“向右”或“不”);使用催化剂,上述反应的△H________(填“增大” “减小” 或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡 移动(填“向左”“向右”或“不”);使用催化剂,上述反应的△H________(填“增大” “减小” 或“不改变”)。
(2)一氧化碳在高温下与水蒸气反应的方程式为:CO+H2O=CO2+H2。已知部分物质燃烧的热化学方程式如下: 2H2(g) + O2(g)= 2H2O(l);△H=-571.6kJ·mol-1
2CO (g) + O2(g)= 2CO2 (g) ;△H=-566kJ·mol-1
又知1molH2O(g)转变为1mol H2O(l)时放出44.0kJ热量。写出CO和水蒸气在高温催化剂下反应的热化学方程式 。
(3)在25℃下,向浓度均为0.1 mol・L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学 式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。
式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。
(4)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl—NH4Cl为电解质溶液制造新型燃烧电池,放电过程中,溶液中铵根离子浓度逐渐增大。请写出该电池的正极反应式 。
(5)某温度(t℃)时,测得0.01mol·L-1的NaOH溶液的pH=11。在此温度下,将pH=1的H2SO4溶液VaL与pH=11的NaOH溶液VbL混合,若所得混合液为 中性,则Va︰Vb= 。
中性,则Va︰Vb= 。
(6)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-)。则溶液显_____________性(填“酸”“碱”或“中”);
(7)NH4Cl是一种重要的化肥。
①用0.1 mol·L—1的盐酸滴定0.1 mol·L—1的氨水,滴定过程中不可能出现的结果是:
a.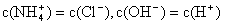
b.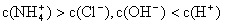
c.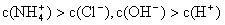
d.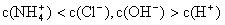
②NH4Cl溶液中存在:NH4+ + H2O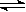 NH3·H2O + H+,则该反应常温下的平衡常数K= (已知:常温下,NH3·H2O的电离平衡常数Kb=1.7×10—5 mol·L—1)
NH3·H2O + H+,则该反应常温下的平衡常数K= (已知:常温下,NH3·H2O的电离平衡常数Kb=1.7×10—5 mol·L—1)
在①浓H2SO4②稀H2SO4③浓HNO3④稀盐酸⑤NaOH溶液⑥氨水 ⑦双氧水 ⑧氯气 ⑨铁粉 ⑩铜粉中选择最佳试剂,除去下列物质中所含有的少量杂质(括号内是杂质,填序号)。
(1)Fe2O3(SiO2)。(2)Na2CO3溶液(NaHCO3)。
(3)FeCl3溶液(FeCl2)。 (4)铁粉(铝粉)。
铅蓄电池是可充电型电池,它的正负极极板是惰性材料,电池总反应式为:
Pb+PbO2+4H++2SO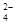
 2PbSO4+2H2O
2PbSO4+2H2O
请回答下列问题(不考虑氢、氧的氧化还原):
(1) 该蓄电池放电工作时的负极材料是,用其电解氯化钠溶液,当阳极上收集到11.2L氯气时(标况下),理论上负极板的质量增加g。
充电时,上图中A极应接直流电源的(填“正极”或“负极”)。充电时A极的电极反应式是;
(2) MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式 。现以铅蓄电池为电源电解,当蓄电池中有0.4mol H+被消耗时,则电路中通过的电子的物质的量为,MnO2的理论产量为 g。
A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
| 阳离子 |
Na+、K+、Cu2+ |
| 阴离子 |
SO42-、OH- |
如图1所示装置中,甲、乙、丙三个烧杯中依次盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为石墨电极。接通电源,经过一段时间后,测得乙中c电极质量增加了16 g。常温下各烧杯中溶液的pH与电解时间t的关系如图2所示。请回答下列问题:
(1) M为直流电源的________极,b电极上发生的电极反应为_____________。
(2) 计算e电极上生成的气体在标准状况下的体积为________________。
(3) 写出乙烧杯中的总反应的离子方程式:______________________________。
(4) 要使丙烧杯中的C溶液恢复到原来的状态,需要进行的操作是(写出要加入的物质和质量)。
(1)利用反应6NO2+8NH3 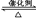 7N2+12 H2O可处理大气中的污染物NO2。当转移1.2 mol电子时,消耗的NO2在标准状况下是L。
7N2+12 H2O可处理大气中的污染物NO2。当转移1.2 mol电子时,消耗的NO2在标准状况下是L。
已知:2SO2(g)+O2(g) 2SO3(g)ΔH="-196.6" kJ·mol-1
2SO3(g)ΔH="-196.6" kJ·mol-1
2NO(g)+O2(g) 2NO2(g)ΔH="-113.0" kJ·mol-1
2NO2(g)ΔH="-113.0" kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH=kJ·mol-1。
SO3(g)+NO(g)的ΔH=kJ·mol-1。
(2)物质A~E都是中学化学中常见的物质,它们可发生如图所表示的反应:
在以上反应中(用序号填空):属于氧化还原反应的是;属于复分解反应的是。反应③的离子方程式为:
若以反应⑦设计一个原电池,则原电池的负极材料应为。
高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比C12、O2、C1O2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钾的主要反应为:
2FeSO4 + 6Na2O2= 2Na2FeO4 + 2Na2O + 2Na2SO4 + O2↑
①该反应中的氧化剂是,还原剂是,每生成lmolNa2FeO4转移mol电子。
②简要说明K2FeO4作为水处理剂时所起的作用。
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种数粒:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。
①写出并配平湿法制高铁酸钾的离子反应方程式:。
②每生成1mol FeO42- 转移mo1电子,若反应过程中转移了0.3mo1电子,则还原产物的物质的量为mo1。
③低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),说明什么问题。