(每空1分共6分)
一定温度下,有a.盐酸、b.硫酸c.醋酸三种酸:①当其物质的量浓度相同时,C(H+)由大到小的顺序是 。(用a、b、c表示,下同)
②同体积、同物质的量浓度的三种酸溶液,中和NaOH的能力由大到小的顺序是 ___________________
③当C(H+)相同时,物质的量浓度由大到小的是___
④当C(H+)相同、体积相同时,分别加入足量锌,相同状况下产生的气体体积由大到小的顺序是______________
⑤当C(H+)相同、体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的氢气(相同状况)则开始时反应速率的大小关系是 ______________
⑥将C(H+)相同的三种酸溶液均加水稀释至体积为原来的10倍后,C(H+)由大到小的顺序为______________
某温度时,在2 L容器中X、Y、Z三种物质随时间的变化曲线如图所示: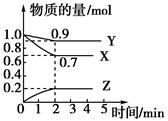
(1)由图中的数据分析,该反应的化学方程式为__________________________。
(2)反应开始至2 min时Z的平均反应速率为____________。
乙烯和苯是两种重要的化工原料,现有同学分别取这两种物质进行实验:
| 实验步骤 |
实验现象 |
解释及相关反应方程式 |
| 将乙烯通入溴水中 |
发生了反应(填反应类型),反应方程式: |
|
| 将苯与溴水混合振荡,静置 |
溴在苯中的溶解度比在水中的溶解度;苯的密度比水。 (填“大”或“小”) |
下图烧杯中盛有稀硫酸,则:
(1)A中进行的离子反应方程式为。
(2)B中各电极的电极反应式:负极:;正极: 。
(3)C中被腐蚀的金属是,正极反应。
(4)三烧杯中铁被腐蚀的速率由快到慢的顺序是。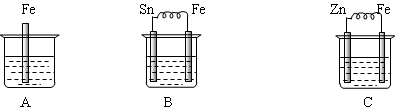
(教材变式题)对于反应:2SO2+O2 2SO3,当其他条件不变时,只改变一个反应条件,将生成SO3的反应速率的变化填入空格里(填写“增大”“减小”“不变”)
2SO3,当其他条件不变时,只改变一个反应条件,将生成SO3的反应速率的变化填入空格里(填写“增大”“减小”“不变”)
| 编号 |
改变的条件 |
化学反应速率 |
| ① |
降低温度 |
|
| ② |
增大O2的浓度 |
|
| ③ |
使用V2O5作催化剂 |
|
| ④ |
压缩体积 |

现有0.1mol·L-1的Na2SO4和0.1mol·L-1的H2SO4混合溶液100mL,向其中逐滴加入0.2mol·L-1的Ba(OH)2溶液,并不断搅拌,使反应充分进行。
⑴当加入50mLBa(OH)2溶液时,发生反应的离子方程式为,所得溶液中的溶质是,其物质的量浓度为mol·L—1;
⑵当溶液中沉淀量达到最大时,所加Ba(OH)2溶液的体积为mL,所得溶液中溶质,则该溶质物质的量浓度为 mol·L-1。