现有0.1mol·L-1的Na2SO4和0.1mol·L-1的H2SO4混合溶液100mL,向其中逐滴加入0.2mol·L-1的Ba(OH)2溶液,并不断搅拌,使反应充分进行。
⑴当加入50mLBa(OH)2溶液时,发生反应的离子方程式为 ,所得溶液中的溶质是 ,其物质的量浓度为 mol·L—1;
⑵当溶液中沉淀量达到最大时,所加Ba(OH)2溶液的体积为 mL,所得溶液中溶质 ,则该溶质物质的量浓度为 mol·L-1。
对于反应:CO(g)+H2O(g)  CO2(g)+H2 (g)ΔH>0请回答下列问题:
CO2(g)+H2 (g)ΔH>0请回答下列问题:
(1)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生上述反应,CO和H2O浓度变化如图,则 0~4min内的平均反应速率v(CO)=______ mol/(L·min)
(2)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如下表。
则:
①C1数值___(选填“>”、“<”或“=”)0.08 mol/L。
②反应在4min~5min间,平衡向逆反应方向移动,可能的原因是________(单选);表中5min—6min之间数值发生变化,可能的原因是__________(单选)。
a.增加水蒸气 b.降低温度
c.使用催化剂d.增加氢气浓度
按要求回答下列问题:
(1)已知:
| 1 mol分子中的化学键断时需要吸收能量/kJ |
H2(g) |
Cl2(g) |
HCl(g) |
| 436 |
243 |
431 |
则:H2(g) + Cl2(g)  2HCl(g)ΔH=kJ/mol
2HCl(g)ΔH=kJ/mol
(2)已知:乙醇的燃烧热为1411.0 kJ/mol,则乙醇燃烧的热化学方程式可表示为。
(3)在200℃、101kPa时,H2与碘蒸气作用生成2molHI气体,放出14.9kJ的热量。
热化学方程式可表示为。
(4)已知:①2CH3OH(l)+3O2(g)  2CO2(g)+4H2O(g)ΔH1=-1 275.6 kJ/mol
2CO2(g)+4H2O(g)ΔH1=-1 275.6 kJ/mol
②2CO(g)+O2(g) 2CO2(g)ΔH2=-566.0 kJ/mol
2CO2(g)ΔH2=-566.0 kJ/mol
③H2O(g) H2O(l)ΔH3=-44.0 kJ/mol
H2O(l)ΔH3=-44.0 kJ/mol
上述三个反应中,ΔS<0的是。甲醇燃烧生成一氧化碳和液态水的热化学方程式是。
按要求回答下列问题:
(1)NaHCO3的电离方程式是。
(2)FeCl3水解的离子方程式是。
(3)硫代硫酸钠(Na2S2O3)溶液与稀硫酸反应的化学方程式是。
(4)将TiCl4加入热水中生成TiO2.xH2O的化学方程式是。
已知A、B、C、D为气体,其中A为黄绿色,D极易溶于水,形成的溶液可使酚酞变红,它们之间的转化关系如下图①所示:
(1)将气体B点燃,把导管伸入盛满气体A的集气瓶,反应过程中的实验现象有(填序号)。
①放热②黄绿色褪去③瓶口有白雾④瓶口有白烟
⑤安静燃烧,发出黄色火焰⑥安静燃烧,发出苍白色火焰
(2)实验室制D的化学方程式为。
(3)实验室可用如上图②所示装置收集D,下列叙述正确的是(填序号)。
①D气体不能用排水法收集
②干燥管里盛有碱石灰
③图②中试管口处的a为棉花团,其作用是防止氨气逸出
(4)气体D催化氧化的化学方程式为。
(5)物质E的化学式是;E在下列物质分类中所属的物质种类是(填序号)。
①电解质②化合物③混合物④纯净物⑤非电解质⑥盐
某小组同学要配制100 mL 0.100 mol·L-1 Na2CO3溶液。下图是一些关键步骤和操作。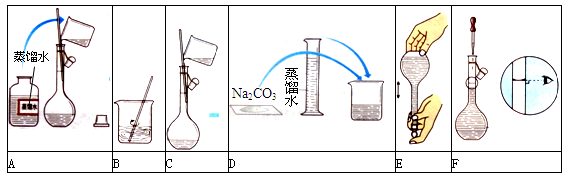
(1)配制过程的先后顺序为(用字母A~F填写)。
(2)配制过程所需的玻璃仪器有烧杯、玻璃棒、量筒、。
(3)若用Na2CO3·10H2O晶体来配制溶液,但晶体已经部分失去结晶水,则所配得溶液的浓度会(填“偏高”、“偏低”、“不变”)。
(4)步骤A通常称为洗涤,如果没有步骤A,则配得溶液的浓度将(填“偏高”、“偏低”、“不变”);步骤F称为,如果俯视刻度线,配得溶液的浓度将(填“偏高”、“偏低”、“不变”)。
(5)在步骤B之后,需才进行下一步操作。