(14分)氮、磷及其化合物在科研及生产中均有着重要的应用。
(1)某课外学习小组欲制备少量NO气体,写出铁粉与足量稀硝酸反应制备NO的离子方程式: 。
(2)LiFePO4是一种新型动力锂电池的电极材料。
①下图为某LiFePO4电池充、放电时正极局部放大示意图,写出该电池放电时正极反应方程式: 。
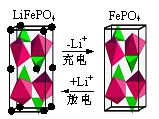
②将LiOH、FePO4·2H2O(米白色固体)与还原剂葡萄糖按一定计量数混合,在N2中高温焙烧可制得锂电池正极材料LiFePO4。焙烧过程中N2的作用是 ;实验室中以Fe3+为原料制得的FePO4·2H2O有时显红褐色,FePO4·2H2O中混有的杂质可能为 。
(3)磷及部分重要化合物的相互转化如图所示。
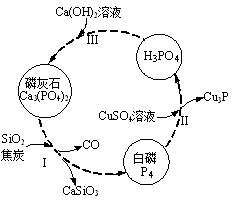
①步骤Ⅰ为白磷的工业生产方法之一,反应在1300℃的高温炉中进行,其中SiO2的作用是用于造渣(CaSiO3),焦炭的作用是 。
②不慎将白磷沾到皮肤上,可用0.2mol/L CuSO4溶液冲洗,根据步骤Ⅱ可判断,1molCuSO4所能氧化的白磷的物质的量为 。
③步骤Ⅲ中,反应物的比例不同可获得不同的产物,除Ca3(PO4)2外可能的产物还有 。
前四周期原子序数依次增大的元素A,B,C,D中,A和B的价电子层中未成对电子均只有1个,平且A-和B+的电子相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2。
回答下列问题:
(1)D2+的价层电子排布图为_______。
(2)四种元素中第一电离最小的是________,电负性最大的是________。(填元素符号)
(3)A、B和D三种元素责成的一个化合物的晶胞如图所示。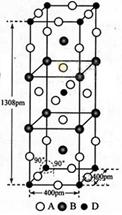
①该化合物的化学式为_________________;D的配位数为___________;
②列式计算该晶体的密度_______g·cm-3。
(4)A-、B+和C3+三种离子组成的化合物B3CA6,其中化学键的类型有_____________;该化合物中存在一个复杂离子,该离子的化学式为_______________,配位体是____________。
硅是重要的半导体材料,构成了现代电子工业的基础。请回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号为 ,该能层具有的原子轨道数为 、电子数为 。
(2)硅主要以硅酸盐、 等化合物的形式存在于地壳中。
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以 相结合,其晶胞中共有8个原子,其中在面心位置贡献 个原子。
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备。工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为 。
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
| 化学键 |
C—C |
C—H |
C—O |
Si—Si |
Si—H |
Si—O |
| 键能/(kJ•mol-1 |
356 |
413 |
336 |
226 |
318 |
452 |
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是 。
②SiH4的稳定性小于CH4,更易生成氧化物,原因是 。
(6)在硅酸盐中,SiO4- 4四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为 ,Si与O的原子数之比为 ,化学式为 。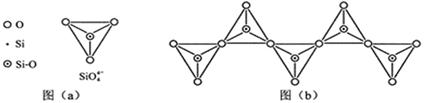
碳族元素包括C、Si、Ge、Sn、Pb。
(1)碳纳米管由单层或多层石墨层卷曲而成,其结构类似于石墨晶体,每个碳原子通过 杂化与周围碳原子成键,多层碳纳米管的层与层之间靠 结合在一起。
(2)CH4中共用电子对偏向C,SiH4中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为 。
(3)用价层电子对互斥理论推断SnBr2分子中Sn—Br键的键角 120°(填“>”、“<”或“=”)。
(4)铅、钡、氧形成的某化合物的晶胞结构是Pb4+处于立方晶胞顶点,Ba2+处于晶胞中心,O2-处于晶胞棱边中心。该化合物化学式为 ,每个Ba2+与 个O2-配位。
Q、R、X、Y、Z五种元素的原子序数依次递增。已知:
①Z的原子序数为29,其余的均为短周期主族元素;
②Y原子价电子(外围电子)排布msnmpn;
③R原子核外L层电子数为奇数;
④Q、X原子p轨道的电子数分别为2和4。
请回答下列问题:
(1)Z2+的核外电子排布式是 。
(2)在[Z(NH3)4]2+中,Z2+的空轨道接受NH3分子提供的 形成配位键。
(3)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是 。
a.稳定性:甲>乙,沸点:甲>乙
b.稳定性:甲>乙,沸点:甲<乙
c.稳定性:甲<乙,沸点:甲<乙
d.稳定性:甲<乙,沸点:甲>乙
(4) Q、R、Y三种元素的第一电离能数值由小到大的顺序为
(用元素符号作答)。
(5)Q的一种氢化物相对分子质量为26,其中分子中的σ键与π键的键数之比为 。
(6)五种元素中,电负性最大与最小的两种非金属元素形成的晶体属于 。
(1)A、B、C、D是周期表中前10号元素,它们的原子半径依次减小。D能分别与A、B、C形成电子总数相等的多原子分子M、N、W,且在M、N、W分子中,A、B、C原子都采取sp3杂化。
①A、B、C的第一电离能由小到大的顺序为_____ (用元素符号表示)。A22-与C22+互为等电子体,C22+的电子式__________
②N的沸点比其同族相邻氢化物沸点高的主要原因是_____。W分子的空间构型的名称是_________
(2)E、F、G三元素的原子序数依次增大,它们原子的最外层电子排布均为4s1。
①F元素基态原子电子排布式为_____
②E元素单质的晶体堆积模型为_____(填字母)
a.简单立方堆积 b.体心立方堆积 c.六方最密堆积 d.面心立方最密堆积
③向G的硫酸盐溶液中通入过量N气体,可生成[G(N)4]2+不考虑空间构型,[G(N)4]2+
的结构可用示意图表示为_____ (用元素符号表示)。