(1)高炉炼铁过程中发生的主要反应为:1/3Fe2O3(s)+CO(g)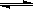 2/3Fe (s)+CO2(g),已知该反应在不同温度下的平衡常数如下。则:
2/3Fe (s)+CO2(g),已知该反应在不同温度下的平衡常数如下。则:
①该反应的△H_____0(填“>”、“<”或“=”);
②在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过l0 min后达到平衡。求CO的平衡转化率= ________。
(2)常温下,HR(酸)溶液pH=3,MOH(碱)的溶液pH=11,两者等体积混合后溶液显碱性。则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式
___________________________________________。
(3)25℃时,pH=0的HCl、0.1mol/L的HCl、0.01mol/L的NaOH、pH=14的NaOH四种溶液中由水电离产生的c(H+)之比为 。
(4)已知25℃时,电离常数Ka(HF)=3.6×10-4,则0.1 mol·L-1 HF溶液中c(H+)= mol·L-1。
常温下,10ml某烃A和80ml O2(过量)混合,点燃使其充分燃烧后恢复到原始状态,残留气体体积为65ml。
(1)若A为烷烃,则其分子式为
(2)若A为烯烃,则其分子式为
(3)若A为炔烃,则其分子式为
(4)若A为本或苯的同系物,则其分子式为
有机化学反应因反应条件不同,可生成不同的有机产品。例如:
(1) (X为卤素原子)
(X为卤素原子)
(2)苯的同系物与卤素单质混合,若在光照条件下,侧链上氢原子被卤素原子取代;若在催化剂作用下,苯环上的氢原子被卤素原子取代。
工业上利用上述信息,按下列路线合成结构简式为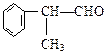 的物质,该物质是一种香料。
的物质,该物质是一种香料。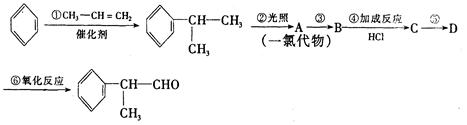
请根据上述路线,回答下列问题:
(1)A的结构简式可能为____________________________________。
(2)反应①、③、⑤的反应类型分别为________、________、_______。
(3)反应④的化学方程式为(有机物写结构简式,并注明反应条件):
______________________________________________。
(4)这种香料具有多种同分异构体,其中某些物质有下列特征:①其水溶液遇FeCl3溶液呈紫色②分子中有苯环,且苯环上的一溴代物有两种。写出符合上述条件的物质可能的结构简式(只写两种):
____________________________________________________________。
已知:①R— —
—
②苯环上原有的取代基对新导入的取代基进入苯环的位置有显著影响。
以下是用苯作原料制备一系列化合物的转化关系图:
(1)A转化为B的化学方程式是_______________________________________。
(2)图中“苯→①→②”省略了反应条件,请写出①、②物质的结构简式:
①________________________,②____________________________。
(3)B在苯环上的二氯代物有种同分异构体。
(4)有机物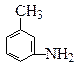 的所有原子(填“在”或“不在”)同一平面上。
的所有原子(填“在”或“不在”)同一平面上。
正盐A能发生下图所示的反应,图中①~⑧分别代表有关反应中的一种物质(某些物质已略去),其中①、②、④、⑤为无色气体。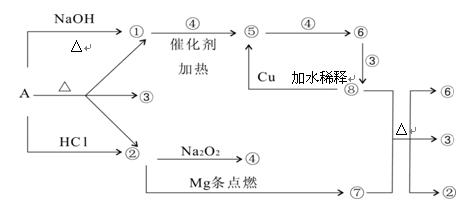
请完成下列各题:
(1)写出化学式A ⑥ ⑦
(2)写出下列反应方程式:
⑧+⑦ ②+③+⑥:
②+③+⑥:
①+④ ⑤:
⑤:
(3)⑧ ⑤的离子方程式为:
⑤的离子方程式为:
把正确答案序号填写在题中的横线上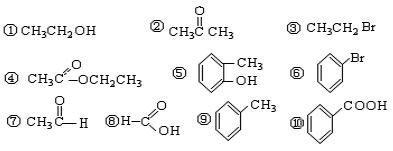
以上属于下列种类的是:
(1)芳香烃:;(2)卤代烃:;(3)醇:;
(4)酚:;(5)醛: