过氧化钙(CaO2)是一种对环境友好的多功能无机化合物,通常有两种制备方法。
已知:温度过高过氧化钙会分解生成氧化物和氧气。
【方法1】由Ca(OH)2为原料最终制得,其制备流程如下:
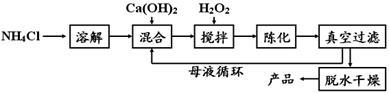
【方法2】由鸡蛋壳(含CaCO3高达90%)为原料最终反应制得,其制备流程如下:

(1)方法1中搅拌的目的是 ;请将搅拌过程中发生反应的化学方程式补充完整:CaCl2 + H2O2
+ 2NH3·H2O + 6 = CaO2·8H2O↓+ 2NH4Cl;制备过程中除水外可循环使用的物质是 (填化学式)。
(2)方法2中气体X是 ,实验室常用 溶液来检验;煅烧后的反应是化合反应,也能生成CaO2·8H2O,反应的化学方程式为 ;该反应需控制温度在0~ 2℃,可将反应器放置在 中,获得CaO2产品中主要含有的固体杂质是 (填化学式)。
(3)这两种制法均要求在低温下进行(除煅烧外),温度过高除了防止氨水挥发外,还能 。
(4)“绿色化学”一般是指反应物的原子全部转化为期望的最终产物,则上述两种方法中生成CaO2·8H2O的反应符合“绿色化学”的是 (填“方法1”或“方法2”)。
将除去氧化膜的镁条投入到盛有稀盐酸的试管中,产生H2的速率变化情况如下图所示。
图中t1~t2速率变化的主要原因是___________,t2~t3速率变化的主要原因是_。
某温度下,在2 L的密闭容器中,X、Y、Z三种物质随时间变化的曲线如图所示。
由图中数据分析:该反应的化学方程式为:。反应开始至2 min ,Z的平均反应速率为。
硫代硫酸钠(Na2S2O3)可看成是一个S原子取代了NazS04中的一个O原子而
形成。某校化学研究性学习小组运用类比学习的思想,通过实验探究Na2S2O3的化学
性质。
【提出问题】Na2S2O3是否与Na2S2O4相似而具备下列性质呢?
猜想①:溶液呈中性,且不与酸反应;
猜想②:无还原性,不能被氧化剂氧化。
【实验探究】基于上述猜想①②,设计实验方案。
实验操作过程 |
实验现象或 预期实验现象 |
现象解释 (用离子方程式表示) |
|
▲ |
溶液pH=8 |
||
| 猜想① |
向Ph=2的硫酸中滴加 Na2S2O3溶液 |
▲ |
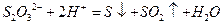 |
猜想② |
向新制氯水(pH<2)中滴 加少量Na2S2O3溶液 |
氯水颜色变浅 |
▲ |
【实验结论】Na2S2O3能与酸反应,具有还原性,与Na2S2O4的化学性质不相似。
【问题讨论】
(1)甲同学取探究“猜想②”反应后的溶液少量,滴加硝酸银溶液,观察到有白色沉淀并
据此认为氯水可将Na2S2O3氧化。你认为该方案是否合理并说明理由▲ 。
(2)若方案不合理,请你设计一个实验方案,证明Na2S2O3。被氯水氧化▲ 。
(Ⅰ)常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如下表所示:
实验编号 |
HA的物质的量 浓度(mol·L-1) |
NaOH的物质的量 浓度(mol·L-1) |
混合后 溶液的pH |
| 甲 |
0.1 |
0.1 |
pH=a |
| 乙 |
0.12 |
0.1 |
pH=7 |
| 丙 |
0.2 |
0.1 |
pH>7 |
| 丁 |
0.1 |
0.1 |
pH=10 |
(1)从甲组情况分析,如何判断HA是强酸还是弱酸? ▲ 。
(2)乙组混合溶液中离子浓度c(A—)和c(Na+)的大小关系是▲ 。
A.前者大 B. 后者大 C. 二者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是▲ 。
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):
c(Na+)—c(A-)= ▲ mol·L-1
(Ⅱ)某二元酸(化学式用H2B表示)在水中的电离方程式是:

回答下列问题:
(5)在0.1mol/L的Na2B溶液中,下列粒子浓度关系式正确的是▲ 。
A.c( B2—)+c(HB—)=0.1mol/L B.c( B2—)+ c(HB—)+c(H2B)=0.1mol/L
C c(OH—)=c(H+)+ c(HB—)D.c(Na+)+c(OH)=c(H+)+ c(HB—)
已知H2B在水溶液中存在以下电离:
 一级电离:H2B H++HB-,二级电离:HB- H++B2-
一级电离:H2B H++HB-,二级电离:HB- H++B2-
请回答以下问题:
(1)NaHB溶液 (填“呈酸性”、“呈碱性”或“无法确定”),原因是
。
(2)若0.1mol·L-1的H2B溶液在某温度下的pH=3,c(B2-)=1×10-6mol·L-1,则H2B的一级电离的电离度为 。
(3)某温度下,在0.1mol·L-1的NaHB溶液中,以下关系一定不正确的是()
A.c(H+)·c(OH-)=1×10-14
B.pH>1
C.c(OH-)=2c(H2B)+c(HB-)+c(H+)
D.c(Na+)=0.1mol·L-1≥c(B2-)
|
 (4)某温度下,FeB(s) Fe2+(aq)+B2-(aq)
(4)某温度下,FeB(s) Fe2+(aq)+B2-(aq)