已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH CH3COO‾+H+ ΔH>0。
CH3COO‾+H+ ΔH>0。
(1)常温常压下,在 pH =5的稀醋酸溶液中,c(CH3COO‾)=__________;下列方法中,可以使0.10 mol·L‾1CH3COOH的电离程度增大的是___________。
a.加入少量0.10 mol·L‾1的稀盐酸
b.加热CH3COOH溶液
c.加入少量冰醋酸
d.加水稀释至0.010 mol·L‾1
e.加入少量氯化钠固体
f.加入少量0.10 mol·L‾1的NaOH溶液
(2)将等质量的锌投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V(盐酸)______V(醋酸),反应的最初速率为:υ(盐酸)_____υ(醋酸)。
(3)常温下,向体积为Va mL pH=3的醋酸溶液中滴加pH=11的NaOH溶液Vb mL至溶液恰好呈中性,则Va与Vb的关系是:Va____Vb;溶液中各离子的浓度按照由大到小排序为___________。
(4)已知:90℃时,水的离子积常数为Kw = 38×10‾14,在此温度下,将pH=3的盐酸和pH = 11的氢氧化钠溶液等体积混合,则混合溶液中的c(H+)=____________(保留三位有效数字)。
如图为相互串联的甲乙两个电解池,甲池若为电解精炼铜的装置,请回答:
(1)A极材料和B极材料分别是
a.石墨、精铜 b.石墨、粗铜 c.粗铜、精铜 d.精铜、粗铜
(2)电解质溶液为 。
(3)若甲槽阴极增重12.8g,则乙槽阴极放出气体在标准状况下的体积为 。
(4)若乙槽剩余液体为400mL,求电解后得到碱液的物质的量浓度 。
二氧化硫和氮的氧化物是常用的工业原料,但也是大气的主要污染物。综合治理基污染是环境化学当前的重要研究内容之一。
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)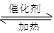 2SO3(g)△H=-198kJ•mol-1
2SO3(g)△H=-198kJ•mol-1
某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如图所示.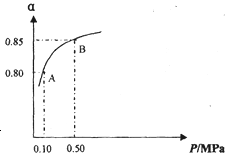
根据图示回答下列问题:
①将2.0mol SO2和1.0mol O2置于10L密闭容器中,反应达平衡后,体系总压强为0.10MPa.该反应的平衡常数等于 _________________。
②平衡状态由A变到B时.平衡常数K(A)____________K(B)(填“>”、“<”或“=”)
(2)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
若用标准状况下4.48L CH4还原NO2至N2,放出的热量为:____________kJ
(1)常温下某溶液中由水电离出的离子浓度符合c(H+)·c(OH-)=1×10-20的溶液,其pH为____________,此时水的电离受到______________。
(2)已知:2NO2(g)===N2O4(g)ΔH=-57.20 kJ·mol-1。一定温度下,在密闭容器中反应2NO2(g)===N2O4(g)达到平衡。其他条件不变时,下列措施能提高NO2转化率的是__________(填字母)。
A.减小NO2的浓度B.降低温度
C.增加NO2的浓度D.升高温度
(3)在某温度下,H2O的离子积常数为1×10-13 mol2·L-2,则该温度下:
①0.01 mol·L-1NaOH溶液的pH=_____________;
②100 mL 0.1 mol·L-1H2SO4溶液与100 mL 0.4 mol·L-1的KOH溶液混合后,pH=___________。
(4)已知一溶液有4种离子:X+、Y-、H+、OH-,下列分析结果肯定错误的是______________。
A.c(Y-)>c(X+)>c(H+)>c(OH-)B.c(X+)>c(Y-)>c(OH-)>c(H+)
C.c(H+)>c(Y-)>c(X+)>c(OH-) D.c(OH-)>c(X+)>c(H+)>c(Y-)
(5)在25 ℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应时溶液中c(NH4+)=c(Cl-)。则溶液显___________(填“酸”“碱”或“中”)性;用含a的代数式表示NH3·H2O的电离常数Kb=________________。
(6)水溶液中的行为是中学化学的重要内容。已知下列物质的电离常数值(25 ℃):
HClO:Ka=3×10-8 HCN:Ka=4.9×10-10 H2CO3:Ka1=4.3×10-7 Ka2=5.6×10-11
84消毒液中通入少量的CO2,该反应的化学方程式为_____________________。
反应A(g)+B(g)⇌C(g)+D(g)过程中的能量变化如图所示(E1>0,E2>0),回答下列问题。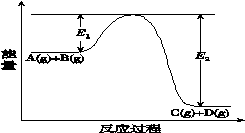
①图中E1代表的意义是_____________________。
该反应是______________反应(填“吸热”或“放热”)。反应热ΔH的表达式为________________。
②当反应达到平衡时,升高温度,A的转化率______________(填“增大”“减小”或“不变”)。
(2)800 ℃时,在2 L密闭容器内充入0.50 mol NO和0.25 mol O2,发生如下反应:2NO(g)+O2(g)===2NO2(g)ΔH<0。体系中,n(NO)随时间的变化如下表:
| t/s |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)/mol |
0.50 |
0.35 |
0.28 |
0.25 |
0.25 |
0.25 |
①能说明该反应已达到平衡状态的是______________。
A.v(NO2)正=v(O2)逆B.容器内压强保持不变
C.v(NO)逆=2v(O2)正 D.容器内气体颜色不变
②能使该反应的反应速率增大,且平衡向正反应方向移动的措施是______________。
A.适当升高温度 B.缩小反应容器的体积
C.增大O2的浓度D.选择高效催化剂
目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究。已知在不同温度下的化学反应。平衡常数(K1、K2、K3)如下所示: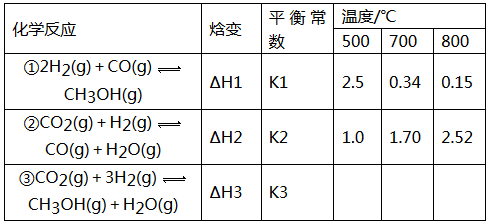
请回答下列问题:
(1)反应②是______________(填“吸热”或“放热”)反应。
(2)据反应①与②可推导出K1、K2与K3之间的关系,则K3=_____________(用K1、K2表示)。
(3)要使反应③在一定条件下建立的平衡逆向移动,可采取的措施有_______________(填字母序号)
A.缩小反应容器的容积 B.扩大反应容器的容积
C.升高温度 D.使用合适的催化剂
E.从平衡体系中及时分离出CH3OH
(4)500℃时,测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol·L-1)分别为0.8、0.1、0.3、0.15,则此时v正____________v逆(填“>”、“=”或“<”).
(5)甲醇是重要的基础化工原料,又是一种新型的燃料,最近有人制造了一种燃料电池,一个电极通入空气,另一个电极加入甲醇,电池的电解质是掺杂了Y2O3的ZrO2晶体,它们在高温下能传导O2-离子,该电池的正极反应式为_________________。电池工作时,固体电解质里的O2-向_____________极移动。
(6)300℃时,在一定的压强下,5molCO与足量的H2在催化剂的作用下恰好完全反应变化的热量为454kJ。在该温度时,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
下列说法正确的是______________________。
A.2c1>c3 B.a+b<90.8C.2p 2<p3D.α1+α3<1