已知A(g)+B(g) C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
| |温度/ ℃ |
700 |
900 |
830 |
1000 |
1200 |
| 平衡常数 |
1.7 |
1.1 |
1.0 |
0.6 |
0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K= ,△H 0(填“<”“ >”“ =”);
(2)830℃时,向一个2 L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.005 mol·L-1·s-1。,则6s时c(A)= mol·L-1, C的物质的量为 mol;若反应经一段时间后,达到平衡时A的转化率为 ;
(3)判断该反应是否达到平衡的依据为 (填正确选项前的字母):
a.压强不随时间改变 b.c(A)不随时间改变
c.气体的密度不随时间改变 d.单位时间里生成C和D的物质的量相等
(4)1000℃时反应C(g)+D(g)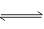 A(g)+B(g)的平衡常数的值为 。
A(g)+B(g)的平衡常数的值为 。
已知某温度下,Kw=l×10-13。A为酸溶液,其pH=a;B为碱溶液,其pH=b。
(1)若A为强酸,B为强碱,且a + b=13,两者等体积混合后,溶液的pH=;若此时溶液中阳离子浓度大于阴离子浓度,其原因可能是(用文字表述)___________________________________________________________
(2)若A的化学式为HR, B的化学式为MOH,且a + b = 13。若两者等体积混合
后溶液显碱性,则其原因可能是_________________________________________,
此混合后的溶液中,微粒浓度大小关系一定正确的是_______________填序号)。
① c(MOH)> c ( M + ) > c ( R一)> c ( H + ) > c ( OH一)
② c ( HR ) > c ( M + ) > c ( R一)> c ( OH一)> c ( H + )
③ c(M +)> c ( R一)> c ( H + ) > c ( OH一)
④ c ( M + ) > c ( R一)> c ( OH一)>c(H +)
⑤ c ( M + ) + c ( H + ) =" c" ( R 一)+ c ( OH一)
⑥ c ( MOH ) =" c" (H +)-c(OH一)
在0.5L的密闭容器中,一定量的氮气和氢气进行
如下化学反应:N2(g)+3H2(g) 2NH3(g) ⊿H<0,其化学平衡常数K与温度t的关系如右表:
2NH3(g) ⊿H<0,其化学平衡常数K与温度t的关系如右表:
| t/℃ |
200 |
300 |
400 |
| K |
K1 |
K2 |
0.5 |
请完成下列问题;
(1)试比较K1、K2的大小,K1K2(填写“>”、“=”或“<”)
(2)下列各项能作为判断该反应达到化学平衡状态 的依据是(填序号字母)
的依据是(填序号字母)
a.容器内N2、H2、NH3的浓度之比为1∶3∶2 b.υ(N2)正=3υ(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
(3)400℃时,反应2NH3(g)  N2(g)+3H2(g)的化学平衡常数的值为。
N2(g)+3H2(g)的化学平衡常数的值为。
当测得NH3和N2、H2的物质的量分别为3 mol和2 mol、1 mol时,则该反应的
υ(N2)正υ(N2)逆(填写“>”、“=”或“<”)
(4)(3)中反应平衡时,升高温度,NH3转化率(填“变大”、“变小”、“不变”)
有以下几种物质①干燥的食盐晶体②液态氯化氢③水银④蔗糖⑤冰醋酸(纯醋酸晶体)⑥KNO3溶液⑦CaCO3固体⑧SO3填空回答(填序号):
(1)以上物质能导电的是;(2)以上物质中属于非电解质的是;(3)以上物质中属于电解质的是;(4)属于强电解质的是。
已知:① (弱碱性,易被氧化)
(弱碱性,易被氧化)
②
工业上以苯和C8H6O2Br2(显酸性)为原料合成一种产生电能的新型KEVLAR合成纤维,生产流程为:
根据生产流程,回答下列问题:
(1)写出B的结构简式, 的结构简式.
的结构简式.
(2)写出反应①的化学方程式.
(3)反应②④⑥⑧⑩中属于取代反应的是,设计反应③④⑤的目的是.
(4)E与乙二醇发生聚合反应的化学方程式.
(16分)
有两种位于短周期的相邻周期、相邻主族的非金属元素X、Y.已知两元素最高价氧化物的水化物均为强酸.根据下图转化关系(反应条件及部分产物已略去),回答下列问题:
(1)若A、B、C、D均为含X元素的化合物,且A的一个分子中只含有10个电子,则:
①A的分子构型为。
②反应Ⅰ的化学方程式为。
③化合物NaX3是合成“达菲”的中间活性物质,NaX3受撞击后生成Na3X和另一种气体单质,请写出该反应的化学方程式。
(2)若A、B、C、D均为含Y元素的化合物,且A的摩尔质量为120 g·mol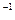 ,则:
,则:
①反应Ⅳ的溶液加热蒸干所得的晶体属于晶体(填“离子”、“分子”、“原子”).
②反应I的化学方程式为。
③若灼烧6gA产生的B(气态)全部转化为C(气态)时放出9.83 KJ热量,请写第Ⅱ步反应的热化学方程式。