已知某温度下,Kw=l×10-13。A为酸溶液,其pH=a;B为碱溶液,其pH=b。
(1)若A为强酸,B为强碱,且a + b=13,两者等体积混合后,溶液的pH= ;若此时溶液中阳离子浓度大于阴离子浓度,其原因可能是(用文字表述)___________________________________________________________
(2)若A的化学式为HR, B的化学式为MOH,且a + b = 13。若两者等体积混合
后溶液显碱性,则其原因可能是_________________________________________,
此混合后的溶液中,微粒浓度大小关系一定正确的是_______________填序号)。
① c(MOH)> c ( M + ) > c ( R一)> c ( H + ) > c ( OH一)
② c ( HR ) > c ( M + ) > c ( R一)> c ( OH一)> c ( H + )
③ c(M +)> c ( R一)> c ( H + ) > c ( OH一)
④ c ( M + ) > c ( R一)> c ( OH一)>c(H +)
⑤ c ( M + ) + c ( H + ) =" c" ( R 一)+ c ( OH一)
⑥ c ( MOH ) =" c" (H +)-c(OH一)
某校高三同学高考前重做以下两个课本实验,请你回答实验过程中的相关问题:
(1)铝热反应实验:取磁性氧化铁粉按课本中的实验装置(如图)进行铝热反应,将反应
后所得“铁块”溶于盐酸,向反应后的溶液中滴加KSCN溶液,发现溶液变血红色。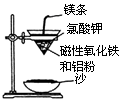
①出现这种现象的原因,除了因“铁块”中可能混有没反应完的
磁性氧化铁外,还有一种可能原因是 。
② 若要证明反应所得“铁块”中含有金属铝,可用(填化学式)溶液,所发生反应的离子方程式为 。
(2)化学反应速率影响因素的探究实验:
KI在经酸化的溶液中被空气氧化的反应式为:4H+ + 4I-+ O2 = 2I2 + 2H2O。该反应的速率受温度、酸度、溶剂、试剂浓度等影响,可用淀粉与碘的显色反应来观测该反应的速率。已知,淀粉与碘的显色反应在温度升高时灵敏度会降低,高于75℃则不能显色;淀粉浓度越高显色越灵敏、颜色也越深。
实验小组拟用0.8 mol·L-1 KI溶液、0.1 mol·L-1H2SO4溶液、淀粉溶液等来探究温度、酸度对上述反应速率的影响,他们做了A—C三组实验,部分实验数据如下表:
| 编号 |
温度/℃ |
H2SO4体积/mL |
KI溶液体积/mL |
H2O体积/mL |
淀粉溶液 / mL |
出现蓝色时间 /s |
| A |
39 |
10 |
5 |
5 |
1 |
5 |
| B |
TB |
10 |
5 |
5 |
1 |
没出现蓝色 |
| C |
5 |
10 |
5 |
5 |
1 |
39 |
| D |
t |
①为确保A组实验在39℃下进行,应采用的控温操作方法是。
②A—C三组实验时,都加入了5mL水,其目的是。
③B组实验中“没出现蓝色”,原因是。
④请你为小组设计D组实验方案(在表格空白处填入你设计的5个数据),以帮助小组完成探究目标。
⑤按你设计的实验数据,请你预测一个t值,并写出与你预测相对应的探究实验结
论。
卤块的主要成分是MgCl2,此外还含Fe2+、Fe3+和Mn2+等杂质离子。以卤块为原料按下图所示流程进行生产,可制得轻质氧化镁。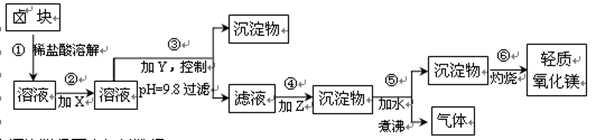
查阅资料得下表相关数据:
| 表1: 生成氢氧化物沉淀的pH |
表2: 原料价格表 |
|||
| 物质 |
开始沉淀 |
沉淀完全 |
物质 |
价格(元/吨) |
| Fe(OH)3 |
2.7 |
3.7 |
a.漂液(含25.2%NaClO) |
450 |
| Fe(OH)2 |
7.6 |
9.6﹡ |
b.双氧水(含30%H2O2) |
2400 |
| Mn(OH)2 |
8.3 |
9.8 |
c.烧碱(含98%NaOH) |
2100 |
| Mg(OH)2 |
9.6 |
11.1 |
d.纯碱(含99.5%Na2CO3) |
600 |
﹡Fe2+氢氧化物呈絮状,不易从溶液中除去,必须将它氧化后以Fe(OH)3沉淀形式才能除尽。
若要求产品尽量不含杂质且生产成本较低,请根据上表提供的资料回答:
(1)流程中加入的试剂X、Y、Z最佳选择依次是表2中的(选填试剂编号)。
(2)步骤②发生反应的离子方程式为;步骤⑤中发生反应的化学方程为。
(3)步骤③控制pH=9.8的目的是。
(4) 若在实验室进行步骤⑥的灼烧实验,必须用到的仪器是铁三脚、酒精喷灯、和
泥三角。
(5)在探究Mg(OH)2溶解性的实验中,发现向装有少量Mg(OH)2浊液的试管中加入适量
NH4Cl晶体,充分振荡后溶液会变澄清,请用化学平衡的原理解释浊液变澄清的原
因。
汽车尾气是城市空气的主要污染物之一,其主要有害成分是CO、氮氧化物(NOx)等。
(1)NOx产生的原因之一是汽车发动机工作时引发N2和O2反应,其能量变化值如右图所示,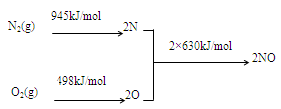
则:N2(g)+O2(g) 2NO(g)△H= 。
2NO(g)△H= 。
(2)汽车尾气中CO、NOx的有效消除成为环保领域的重要课题。某研究小组在实验室用某新型催化剂对CO、NO催化转化进行研究,测得NO转化为N2的转化率随温度、CO混存量的变化情况如下图一。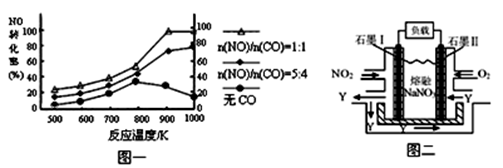
① NO与CO混存时,相互反应的化学方程式为。
② 1000K,n(NO)/n(CO)=5:4时,NO的转化率为75%,则CO的转化率约为。
③ 由于n(NO)/n(CO)在实际过程中是不断变化的,保证NO转化率较高的措施是将温度大约控制在K之间。
(3)汽车尾气中NOx有望通过燃料电池实现转化。已经有人以 NO2、O2和熔融NaNO3制成了燃料电池,其原理如图二。
① 图中石墨Ⅱ为电池的极。
② 在该电池使用过程中,石墨I电极上的产物是氧化物Y,其电极反应式为。
(4)甲醇也可用于燃料电池。工业上采用反应CO2(g)+3H2(g)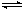 CH3OH(g)+H2O(g) ΔH<0合成甲醇。
CH3OH(g)+H2O(g) ΔH<0合成甲醇。
① 在恒容密闭反应器中,H2的平衡转化率与温度、压强的关
系如图三所示,则A、B、C三点处对应平衡常数(KA、KB、KC)的
大小关系为。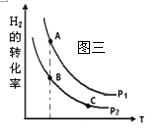
② 某高温下,将6molCO2和8molH2充入2L密闭容器中发生
反应,达到平衡后测得c(CO2)=2.0mol·L-1,则该温度下反应的平
衡常数值为。
化合物E能制解热镇痛药。以苯酚为原料的工业合成路线(部分)如下图:
已知, ,请填写下列空格:
,请填写下列空格:
(1)反应①、②的反应类型 、 ;E的分子式 。
(2)A的结构简式 ,分子中官能团的名称 。
(3)向C溶液中加入少量浓溴水,发生反应的化学方程式 。
D与足量NaOH溶液共热时,发生反应的化学方程式 。
(4)可选用下列试剂中的 (填编号)来鉴别D和B的水溶液。
| A.FeCl3溶液 | B.FeSO4溶液 | C.NaHCO3溶液 | D.NaOH溶液 |
(5)写出一种满足下列三项条件的B的同分异构体的结构简式
①是一种芳香族化合物,②属α-氨基酸,③苯环上有4种不同环境的氢原子。
氯化亚铜(CuCl)是有机合成工业中应用较广泛的催化剂,它是白色粉末,微溶于水,不溶于乙醇,在空气中会被迅速氧化。从酸性电镀废液(主要含Cu2+、Fe3+)中制备氯化亚铜的工艺流程如下:

请回答下列问题:
(1)电镀污泥的主要成分是(写化学式)。
(2)铁粉、氯化钠、硫酸铜在溶液中反应生成CuCl的离子反应方程式为:
。
(3)析出CuCl晶体时的最佳pH在左右。
(4)析出的CuCl晶体要立即用无水乙醇洗涤,然后真空干燥、冷却,密封包装。真空干燥,密封包装的目的是。
(5)从滤液A中可回收的主要物质是(写化学式)。
(6)以碳棒为电极电解CuCl2溶液可得到CuCl。写出电解CuCl2溶液后的阴极上发生的反应为