(13分)A、B、D是由常见的短周期非金属元素形成的单质,常温下A是淡黄色粉末,B、D是气体,F、G、H的焰色反应均为黄色,水溶液均显碱性,E有漂白性。它们之间的转化关系如图所示(部分产物及反应条件已略去),回答下列问题:
(1)A所含元素在周期表中的位置为 ,C的电子式为 。
(2)A与H在加热条件下反应的化学方程式为 。
(3)25℃时,pH均为10的H和G溶液,由水电离出的c(OH-)之比为 。
(4)将A溶于沸腾的G溶液中可以制得化合物I,I在酸性溶液中不稳定,易生成等物质的量的A和E,I在酸性条件下生成A和E的离子方程式为 。I是中强还原剂,在纺织、造纸工业中作为脱氯剂,向I溶液中通入氯气可发生反应,参加反应的I和氯气的物质的量比为1:4,该反应的离子方程式为 。
(5)向含有0.4mol F、0.1 mol G的混合溶液中加入过量盐酸,完全反应后收集到a L气体C(标准状况),取反应后澄清溶液,加入过量FeCl3溶液,得到沉淀3.2g,则a= 。
(14分)现有前20号的A、B、C、D、E五种元素,相关信息于下表:
| 元素 |
信息 |
| A |
元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B |
B原子得一个电子后2p轨道全满 |
| C |
C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大 |
| D |
D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等于其中子数 |
| E |
E+和B- 具有相同的电子层结构 具有相同的电子层结构 |
(1)B的核外电子排布式为________,CB3的晶体类型为________ 。
(2)B、C、D三元素的电负性大小顺序为________>________>________(填元素符号)。
(3)C的氢化物的空间构型为________,其氢化物在同族元素所形成的氢化物中沸点最高的原因是______________________________________________________。
(4)E2D的水溶液呈(填“酸性”、“碱性”或“中性”),用离子方程式解释理由:_______________________。
(5)已知:12.8 g液态C2 A4与足量A2O2反应生成C2和气态A2O,放出256.65 kJ的热量。
A2O (l)=== A2O (g) ΔH=+44 kJ·mol-1。
2 A2O2 (l)===2A2O (l)+O2(g) ΔH=-196.4 kJ·mol-1。
则液态C2 A4与足量O2反应生成C2和液态A2O的热化学方程式为: ________________________________________________。
下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。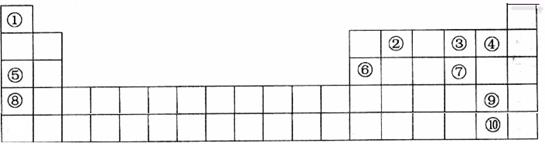
用化学符号回答下列问题:
(1)表中最活泼的金属与最活泼的非金属形成的物质是_______ ___;
(2)⑤、⑥、⑧的最高价水化物的碱性由强到弱的顺序是;
③、④、⑦氢化物稳定性由强到弱的顺序是;
(3)①与⑤按原子个数1:1所成的化合物的电子式为________________ _;该化合物与水反应的离子方程式为________________ _。
(4)⑥号元素最高氧化物水化物与⑤号元素最高价氧化物水化物反应的离子方程式为__________;
(5)请设计一个实验方案,比较⑨、⑩的单质氧化性的强弱:。
下列五种物质中① Ar② H2O2③ NH4 NO3④ KOH⑤ Na2O2⑥ CaCl2只存在共价键的是,只存在离子键的是,既存在共价键又存在离子键的是,不存在化学键的是。(填写序号)
现有一种有机物A,分子式为C4H6O6。对于A的结构与性质实验结论如下:
i:A的分子中有两个羧基;
ii:A的核磁共振氢谱如右图所示;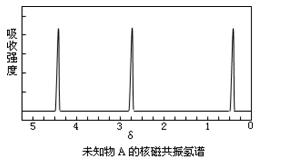
下图是利用烃B和烃I合成有机物A和一种高分子新材料R的转化关系示意图,已知烃I的相对分子质量为28,且F的相对分子质量比E多28。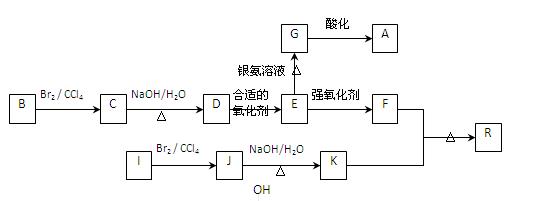
已知:① 
②同一个碳原子上连有多个羟基的结构极不稳定,不予考虑。
请分析并按要求回答下列问题:
(1)分别写出A、R的结构简:、;
(2)写出E中官能团名称;
(3)写出E→G反应的化学方程:;
(4)C→D反应类型; F+K→R;
(5)有机物E的同分异构体M满足下列三个条件:
①1 mol有机物与银氨溶液充分反应生成2 mol Ag
②1 mol有机物与足量NaHCO3溶液反应产生1 mol CO2
③1 mol有机物与足量金属Na反应产生1 mol H2
请判断M的结构可能有种,任写一种M的结构简式。
已知:A、B、C、D、E、F五种元素核电荷数依次增大,属周期表中前四周期的元素。其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中是最高的;F原子核外最外层电子数与B相同,其余各层均充满。请根据以上信息,回答下列问题:
(1)A、B、C、D的第一电离能由小到大的顺序为。(用元素符号表示)
(2)B的氯化物的熔点比D的氯化物的熔点(填高或低),理由是。
(3)E的最高价氧化物分子的空间构型是。
(4)F的核外电子排布式是,F的高价离子与A的简单氢化物形成的配离子的化学式为。
(5)A、F形成某种化合物的晶胞结构如图所示,则其化学式为;(黑色球表示F原子)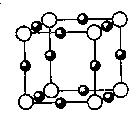
(6)A、C形成的化合物具有高沸点和高硬度,是一种新型无机非金属材料,其晶体中所含的化学键类型。