为实现“绿色奥运”,下列环保建议中你认为可以采纳的是
①用天然气代替汽油和柴油作为发动机燃料
②开发生产无汞电池
③提倡使用一次性发泡塑料餐具和塑料袋
④分类回收垃圾
⑤开发利用无磷洗涤剂
| A.①③④ | B.②③④⑤ | C.①②④⑤ | D.全部 |
为预防“H1N1”甲型流感,同学们每天用“84”消毒液(NaClO溶液)消毒,下列说法正确的是
| A.NaClO溶液的消毒原理是使蛋白质变性 |
| B.1molCl2与足量NaOH溶液反应转移2mol电子 |
| C.NaClO溶液的漂白原理与Na2O2、SO2相同 |
| D.“84”消毒液与“洁厕灵”(盐酸)共同使用,可达到既清洁又消毒的双重效果 |
下列选项中正确的是
| A.1L0.5mol·L-1稀硫酸与1L1mol·L-1氢氧化钠溶液反应放出57.3kJ的热量: H2SO4(aq) +2Na  OH(aq) = Na2SO4(aq) +2H2O(1);△ H = -57.3 kJ· mol-1 OH(aq) = Na2SO4(aq) +2H2O(1);△ H = -57.3 kJ· mol-1 |
B.某酸的酸式盐NaHY水溶液显碱性,则H2Y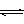 2H++Y2— 2H++Y2— |
C.纯碱溶液显碱性的原因用离子方程式可表示为:CO32—+2H2O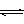 H2CO3+2OH— H2CO3+2OH— |
D.以惰性电极电解KCl溶液的离子方程式为:2Cl-+2H2O  H2↑+2OH-+Cl2↑ H2↑+2OH-+Cl2↑ |
下列溶液中有关物质的量浓度关系正确的是
A.pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+)+c(M+)=c(OH-)+c(A-)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:
c(NaOH)<c(CH3COONa)<c(Na2CO3)
C.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)=c(H+)+c(CH3COOH)
D.常温下,0.1mol·L-1某一元酸(HA)溶液中c(OH-)/c(H+)=1×10-8,由pH=3的HA与pH=11的NaOH溶液等体积混合,溶液中c(Na+)>c(A-)>c(OH-)>c(H+)
300 ml 2 mol/L 硝酸与一定量的铝镁铁合金反应生成 3.36 L NO (标准状况)和铁盐、铝盐、镁盐等,再向反应后的溶液中加入 3 mol/L的NaOH 溶液,使铝镁铁元素恰好全部转化为沉淀,则所加 NaOH 溶液的体积是
| A.150 ml | B.200 ml | C.450 ml | D.无法计算 |
关于下列各装置图的叙述中,正确的是

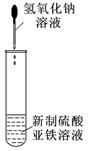
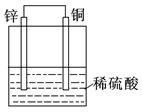
①②③④
| A.实验室用装置①制取氨气 |
| B.装置②中X若为四氯化碳,可用于吸收氨气,并防止倒吸 |
| C.装置③可用于制备氢氧化亚铁并观察其颜色 |
| D.装置④是原电池,锌电极为负极,发生还原反应 |