原子序数依次增大的A、B、C、D都是元素周期表中前20号元素,B、C、D同周期,A、D同主族,且A的原子结构中最外层电子数是电子层数的3倍。D的最高价氧化物对应的水化物为强酸,且B、C、D的最高价氧化物对应的水化物两两混合均能发生反应生成盐和水。根据以上信息,回答下列问题:
(1)D的离子结构示意图是 ,A和B形成的化合物中含有非极性共价键的是 ,该物质的电子式是 。
(2)加热时,D单质能跟B的最高价氧化物对应水化物的浓溶液发生氧化还原反应,生成两种盐,该氧化还原反应的离子方程式为 。
(3)写出C的最高价氧化物对应的水化物与B的最高价氧化物对应的水化物反应的离子方程式 。
氮及其化合物与人们的生活息息相关。
(1)实验室可用铜与稀硝酸反应制取NO,其离子方程式是。
为防止环境污染,可用碱液吸收氮的氧化物。NO与NO2按物质的量之比1∶1被NaOH溶液完全吸收后得到一种钠盐,该化学方程式是。
(2)同温同压下,3.5 L NH3恰好将3.0 LNO和NO2的混合气完全转化为N2,则原混合气中NO和NO2的体积比是 。
(3)含有1mol HNO3的稀硝酸分别与 不同质量的铁粉,所得氧化产物a、b与铁粉物质的量关系如图所示。则:b是n 3 =p=
不同质量的铁粉,所得氧化产物a、b与铁粉物质的量关系如图所示。则:b是n 3 =p= 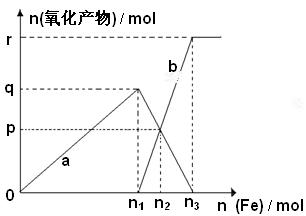
已知反应:
(R、R’可表示烃基或官 能团)
能团)
A可进行如下反应(方框内物质均为有机物,部分无机产物已略去)。
(1)F的蒸气密度是相同条件下H2密度的31倍,且分子中无甲基。已知1 mol F与足量金属钠作用产生H2 22.4 L(标准状况),则F的分子式是,名称是。
(2)G与F的相对分子质量之差为4,则G具有的性质是(填序号)
a.可与银氨溶液反应 b.可与乙酸发生酯化反应
c.可与氢气发生加成反应 d.1 mol G最多可与2 mol 新制Cu(OH)2发生反应
d.1 mol G最多可与2 mol 新制Cu(OH)2发生反应
(3)D能与NaHCO3溶液发生反应,又知两分子D可以反应得到含有六元环的酯类化合物,E可使溴的四氯化碳溶液褪色,则D→E的化学方程式是:。
(4)H与B互为同分异构体,且所含官能团与B相同,则H的结构简式可能是:
、。
(5)A转化为B和F的化学方程式是:
。
在恒温恒容的密闭容器中,通入x mol N2和y mol H2发生反应N2 + 3H2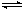 2NH3,达平衡后,测得反应放出的热量为18.4 kJ,混合气体总的物质的量为3.6 mol,容器内的压强变为原来的90%。又知N2和H2的转化率相同。
2NH3,达平衡后,测得反应放出的热量为18.4 kJ,混合气体总的物质的量为3.6 mol,容器内的压强变为原来的90%。又知N2和H2的转化率相同。
⑴通过计算说明起始充入N2和H2的物质的量分别为:x =,y = 。
。
⑵若起始加入N2、H2和NH3的物质的量分别为a mol、b mol、c mol,达平衡时各物质的含量与上 述平衡完全相同。
述平衡完全相同。
①若c=2,在相同的条件下达平衡时,该反应吸收的热量为kJ。
②若维持反应向正反应方向进行,则起始时c的取值范围为。
叠氮化合物应用广泛,如NaN3可用于汽车安全气囊,Hg(N3)2可作雷管的起爆剂,工业上制备NaN3的化学反应为:
I.N2H4(联氨) + HNO2→ HN3(叠氮酸) + H2O (未配平);
+ HNO2→ HN3(叠氮酸) + H2O (未配平);
II.HN3 + NaOH →NaN3 + H2O
⑴上述反应I中,每生成4.3g HN3时,消耗联氨的物质的量为,NaN3受撞击时迅速分解为两种单质,该反应的化学方程式为。
⑵联氨的电子式为。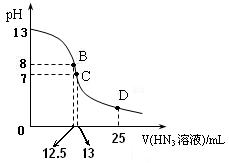
⑶上图为常温下向25mL、0.1mol/L NaOH溶液中逐滴滴加0.2mol/L的HN3溶液的过程中溶液pH的变化曲线。(溶液混合时体积的变化忽略不计)
① D点时溶液中各离子的浓度由大到小的顺序为
D点时溶液中各离子的浓度由大到小的顺序为
② B点时溶液中c  (HN3
(HN3 ) =
) =
mA、B、C是三种常见短周期元素的单质。常温下D为无色液体,E是一种常见的温室气体。其转化关系如图(反应条件和部分产物略去)。试回答: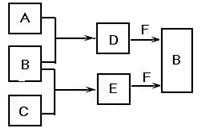
(1)单质X和B或D均能反应生成黑色固体Y,Y的化学式是。
(2)物质Z常用于对空气进行杀菌、净化和水果保鲜等。Z和B的组成元素相同,Z分子中各原子最外层电子数之和为18。Z和酸性碘化钾溶液反应生成B和碘单质,反应的离子方程式是。
(3)取0.3 mol F与足量D充分混合后,所得溶液中再通入0.2 mol E充分反应,最后得到的水溶液中各种离子的浓度由大到小的顺序是(不考虑H+)。
(4)E的大量排放会引发很多环境问题。有科学家提出,用E和H2合成CH3OH和H2O,对E进行综合利用。25℃,10 1 kPa时,该反应的热化学方程式是。
1 kPa时,该反应的热化学方程式是。
(已知甲醇的燃烧热△H=-726.5 kJ/mol,氢气的燃烧热△H=-285.8 kJ/mol )