黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其煅烧产物为SO2和Fe3O4。(1)将0.050molSO2(g)和0.030molO2(g)放入容积为1L的密闭容器中,反应:2SO2(g)+O2(g)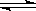 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol/L。计算该条件下反应的平衡常数K和SO2的平衡转化率(写出计算过程)。
2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol/L。计算该条件下反应的平衡常数K和SO2的平衡转化率(写出计算过程)。
(2)已知上述反应是放热反应,当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高SO2平衡转化率的有 (填字母)
A 升高温度 B 降低温度 C 增大压强
D 减小压强 E 加入催化剂 G 移出氧气
(3)SO2尾气用饱和Na2SO3溶液吸收可得到更要的化工原料,反应的化学方程式为
。
(4)将黄铁矿的煅烧产物Fe3O4溶于H2SO4后,加入铁粉,可制备FeSO4。酸溶过程中需保持溶液足够酸性,其原因是 。
[思路分析] 本试题考查“起”、“转”、“平”三步骤计算方法和平衡常数计算方法。
黑火药的成分是硝酸钾、硫磺、木炭。当加热或点燃时会发生剧烈反应而爆炸。生成物中硫元素变为最低价,碳、氮两元素均变成空气中常见的气体。
(1)写出有 关反应的化学方程式:___________________________________________
关反应的化学方程式:___________________________________________
(2)10.1g KNO3完全反应时,被它氧化的碳为_______g。
A、B、C、D、E、F 六种物质有如下变化关系,E是淡黄色粉末,判断: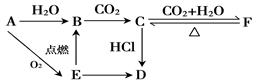
(1)写出下列物质的化学式:
A._____ _____; D.____________ ;
(2)写出有关反应的化学方程式(是离子反应的直接写离子方程式)
B―→C:_____________________________________
E―→B:________________________________________
C―→F:_________________________________________
F―→C:_____________________________________
某学校附近的化工厂排出的污水中因含某些金属离子对水质和环境造成了污染。该校环境保护研究小组的同学对该厂排出的污水取样过滤,对滤液进行了多次检测,其中有三次检测的结果如下表所示。试回答: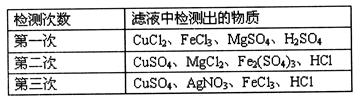
(1)三次检测的结果中第________次检测的结果不正确。
(2)研究小组根据检测结果,向化工厂提出建议:用一种含钠离子的化合物来处理污水,就可以同时除去检测出的金属离子。这种化合物_____________。
(3)在检测时,为了确定滤液中是否存在硫酸根离子和氯离子,同学们将滤液酸化后,首先向滤液中加入过量的_________溶液,将反应后的化合物过滤,再向得到的滤液中加入___________溶液。
⑴Na2CO3固体中混有少量NaHCO3杂质,除去杂质的方法是,反应的化学方程式为
⑵若NaHCO3溶液中混有少量Na2CO3杂质,除去杂质的方法是。
如何鉴别一种白色固体粉末是碳酸氢钠还是碳酸钠?(步骤、现象、结论)
_______________________________________________________________。