(每空2分,共12分)
I、(1)已知1 g H2S气体完全燃烧,生成液态水和二氧化硫气体,放出17.24 kJ热量,请写出H2S气体燃烧热的热化学方程式:
(2)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热。已知0.4 mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256.652KJ的热量。反应的热化学方程式为 。
II、已知常温下在NaHSO3溶液中c(H2SO3 )<c(SO32-) 且H2SO3的电离平衡常数为: K1=1.5×10-2 K2=1.1×10-7 ;氨水的电离平衡常数为K=1.8×10-2;
(1)则等物质的量浓度的下列五种溶液:①NH3·H2O ②KHSO3③KHCO3 溶液中水的电离程度由大到小排列顺序为
(2)0.1 mol·L-1的NaHSO3溶液中C(H+) C(OH-)(“>”、“<”或“=”):
Ⅲ、已知25 ℃时Ksp[Mg(OH)2]=5.6×10-12,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Al(OH)3]=1.1×10-33
(1)在25 ℃下,向浓度均为0.1 mol/L的AlCl3和CuCl2混合溶液中逐滴加入氨水,先生成________沉淀(填化学式)。
(2)溶液中某离子物质的量浓度低于1.0×10-5 mol/L时,可认为已沉淀完全。现向一定浓度的AlCl3和FeCl3的混合溶液中逐滴加入氨水,当Fe3+完全沉淀时,测定c(Al3+)=0.2 mol/L。此时所得沉淀中________(填“含有”或“不含有”)Al(OH)3。
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题。
(1)常温下,某Na2CO3溶液的pH=12,则水电离的c(H+)=。若向该Na2CO3溶液中加入等体积、等物质的量浓度的盐酸,溶液中离子浓度大小排序为。此时溶液中水的电离程度(填“大于”等于或小于”) Na2CO3溶液中水的电离程度。
(2)合成氨反应N2(g)+3H2 (g) 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,
则平衡(填“向正反应方向”“向逆反应方向”或“不”)移动。
(3)一定温度下,在密闭容器中可发生下列反应:2N2O5(g) 4NO2(g)+O2 (g)。下表为反应在T1温度下的部分实验数据:则500 s内N2O5的分解速率V(N2O5)=;降温至T2,反应进行1 000 s时测得c(NO2)=4.98 mol/L。则反应2N2O5(g)
4NO2(g)+O2 (g)。下表为反应在T1温度下的部分实验数据:则500 s内N2O5的分解速率V(N2O5)=;降温至T2,反应进行1 000 s时测得c(NO2)=4.98 mol/L。则反应2N2O5(g) 4NO2(g)+O2 (g)的△H(填“>=或<”)0。
4NO2(g)+O2 (g)的△H(填“>=或<”)0。
| T/s |
0 |
500 |
1000 |
| c(N2O5)/mol•L-1 |
5.00 |
3.50 |
2.42 |
(4)最近美国Simons等科学家发明了使NH3直接用于燃料电池的方法,其装置用铂黑作电极、加入电解质溶液中,一个电极通入空气,另一电极通入NH3。其电池反应式为:4NH3+3O2=2N2+6H2O。你认为电解质溶液应显(填“酸性”“中性”或“碱性”),写出正极的电极反应方程式:。
铁、铜单质及其化合物应用范围很广。现有含氯化亚铁杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按如图步骤进行提纯: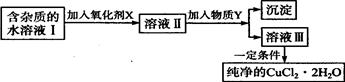
已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH,见下表:
| Fe3+ |
Fe2+ |
Cu2+ |
|
| 氢氧化物开始沉淀时的pH |
1.9 |
7.0 |
4.7 |
| 氢氧化物完全沉淀时的pH |
3.2 |
9.0 |
6.7 |
请回答下列问题。
(1)加入氧化剂的目的是。
(2)最适合作氧化剂X的是。
A.K2Cr2O7B.NaClO C.H2O2D.KMnO4
(3)加入的物质Y是。
(4)若不用物质Y而是直接用碱能不能达到目的?(填“能”或“不能”)。若能,不用回答;若不能,试解释原因:。
(5)最后能不能直接蒸发结晶得到CuCl2·2H2O晶体?(填“能”或“不能”)。若能,不用回答;若不能,回答该如何操作? 。
(6)若向溶液Ⅱ中加入碳酸钙,产生的现象是。
(7)若向溶液Ⅱ中加入镁粉,产生的气体是。试解释原因:。
(8)FeCl3溶液具有净水作用的原因是。
有机物D是一种合成抗高血压药的重要通用中间体,其合成路线如下:(已知A是一种芳香酸)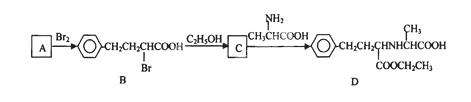
(1)A、C的结构简式分别是、。D中含有的含氧官能团名称是。
(2)C→D的反应类型是。
(3)加热条件下,C在足量NaOH水溶液中反应的化学方程式是。
(4)E是一种相对分子质量比A小14的芳香酸。写出满足下列条件的E的所有同分异构体的结构简式:。
①能发生银镜反应 ②一定条件下可发生水解反应 ③分子的核磁共振氢谱中有四组峰。
(5)F是B在碱溶液中水解后再酸化的产物。F在一定条件下可聚合成高分子化合物,写出该反应的化学方程式。
发展低碳经济,构建低碳社会。科学家们提出利用以工业废气中的CO2为原料,以CuO与ZnO混合物为催化剂,其反应为:CO2+3H2 CH3OH + H2O。
CH3OH + H2O。
(1)某温度下,在体积为l L的密闭容器中充入lmol CO2和4molH2,测得CO2和CH3OH(g)的浓度随时间变化如Ⅰ图所示。从反应开始到平衡,甲醇的平均反应速率v(CH3OH)=;氢气的转化率为。
(2)常温常压下已知下列反应的能量变化如Ⅱ图所示:写出由二氧化碳和氢气制备甲醇的热化学方程式:,该反应的△S___0(填“>”或“<”或“=”);反应达到平衡后,要使该平衡向右移动,其它条件不变时,可以采取的措施有(填序号)。
| A.缩小反应器体积 | B.升高温度 |
| C.恒容条件下通入CO2 | D.使用合适的催化剂 |
(3)在实际生产中发现,随着甲醇的生成,还伴随有少量CO等副产物出现,且CO2的转化率、甲醇和CO的含量还受气体混合物在反应锅炉内的流动速率、催化剂CuO的质量分数影响。通过实验分别得到如下图。
①由图Ⅲ得,生产甲醇的气体最佳流动速率为L•h-1;
②已知当催化剂中没有CuO,只有单组份ZnO时,反应速率最大。说明为什么不选择单组份ZnO的原因,根据图Ⅳ判断,催化剂CuO的质量分数最好为%。
(I)研究CO2的利用对促进低碳社会的构建具有重要的意义。将CO2与焦炭作用生成
CO,CO可用于炼铁等。
(1)已知:Fe2O3(s) + 3C(石墨) =2Fe(s) + 3CO(g) △H 1 =+489 kJ/mol
C(石墨)+CO2 (g)=2CO(g) △H 2 = +172 kJ/mol
则Fe2O3(s) + 3CO(g) = 2Fe (s) + 3CO2(g) △H=。
(2)利用燃烧反应可设计成CO/O2燃料电池(以H2SO4溶液为电解质溶液),写出该电池的正极反应式。
(II)某学生设计了如图所示的装置(框内部分未画出),
在装置内起初发生的反应为Cu+H2SO4H2↑+CuSO4(未注明反应条件),试回答:
(1)该装置的名称是(填“电解池”或“原电池”)。
(2)A、B中至少有一种是金属(填名称),接电源的(填“正极”或“负极”)。
(3)写出该装置中发生还原反应的电极反应方程式为。
(4)若C溶液为100ml饱和食盐水,A 和B电极均为碳棒,该学生利用图示装置进行电解,写出该电解过程中的总反应的离子方程式,当放出标况下112ml氢气时,该溶液的pH=(室温下)。
(III)利用下图装置,可以模拟铁的电化学防护。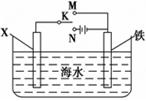
若X为铜,为减缓铁的腐蚀,开关K应置于 处。
若X为锌棒,开关K置于M处,该电化学防护法称为。