有机物D是一种合成抗高血压药的重要通用中间体,其合成路线如下:(已知A是一种芳香酸)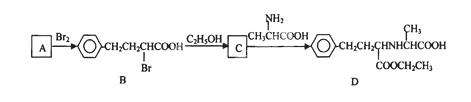
(1)A、C的结构简式分别是 、 。D中含有的含氧官能团名称是 。
(2)C→D的反应类型是 。
(3)加热条件下,C在足量NaOH水溶液中反应的化学方程式是 。
(4)E是一种相对分子质量比A小14的芳香酸。写出满足下列条件的E的所有同分异构体的结构简式: 。
①能发生银镜反应 ②一定条件下可发生水解反应 ③分子的核磁共振氢谱中有四组峰。
(5)F是B在碱溶液中水解后再酸化的产物。F在一定条件下可聚合成高分子化合物,写出该反应的化学方程式 。
氮的固定是几百年来科学家一直研究的课题。
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值。
| 反应 |
大气固氮 N2 (g)+O2 (g) 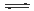 2NO(g) 2NO(g) |
工业固氮 N2 (g)+3H2 (g) 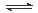 2NH3(g) 2NH3(g) |
|||
| 温度/℃ |
27 |
2000 |
25 |
400 |
450 |
| K |
3.84×10-31 |
0.1 |
5×108 |
0.507 |
0.152 |
①分析数据可知:大气固氮反应属于__________(填“吸热”或“放热”)反应。
②分析数据可知:人类不适合大规模模拟大气固氮的原因__________。
③从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因_______________________。
|
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(р1、р2)下随温度变化的曲线,下图所示的图示中,正确的是________(填“A”或“B”);比较р1、р2的大小关系_________。


 4NH3(g)+3O2(g),则其反应热ΔH=___________________。
4NH3(g)+3O2(g),则其反应热ΔH=___________________。
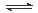 2NH3(g)△H=-92.4kJ·mol-1
2NH3(g)△H=-92.4kJ·mol-1
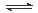 2H2O(l)△H=-571.6kJ·mol-1 )
2H2O(l)△H=-571.6kJ·mol-1 )
碳氧化物、氮氧化物、二氧化硫的处理与利用是世界各国研究的热点问题。
(1)消除汽车尾气中的NO、CO,有利于减少PM2.5的排放。已知如下信息:
I.
II.N2(g)+ O2(g)  2NO(g) ΔH1
2NO(g) ΔH1
2CO(g) + O2(g) 2CO2 (g)ΔH2=" -565" kJ·mol-1
2CO2 (g)ΔH2=" -565" kJ·mol-1
①ΔH1=。
②在催化剂作用下NO和CO转化为无毒气体,写出反应的热化学方程式
③一定条件下,单位时间内不同温度下测定的氮氧化物转化率如图1所示。
温度高于710K时,随温度的升高氮氧化物转化率降低的原因可能是
(2)测定汽车尾气常用的方法有两种。
①方法1:电化学气敏传感器法。其中CO传感器的工作原理如图2所示,则工作电极的反应式为
②方法2:氧化还原滴定法。用H2O2溶液吸收尾气,将氮氧化物转化为强酸,用酸碱中和滴定法测定强酸浓度。写出NO与H2O2溶液反应的离子方程式
(3)工业上可以用NaOH溶液或氨水吸收过量的SO2,分别生成NaHSO3、NH4HSO3,其水溶液均呈酸性。相同条件下,同浓度的两种酸式盐的水溶液中c(SO32-)较小的是,用文字和化学用语解释原因。
“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题。
(1)已知:① CO(g)+H2O(g)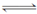 H2(g)+CO2(g) ΔH=-41 kJ·mol-1
H2(g)+CO2(g) ΔH=-41 kJ·mol-1
② C(s)+2H2(g)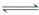 CH4(g) ΔH=-73 kJ·mol-1
CH4(g) ΔH=-73 kJ·mol-1
③ 2CO(g)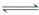 C(s)+CO2(g)ΔH=-171 kJ·mol-1
C(s)+CO2(g)ΔH=-171 kJ·mol-1
写出CO2与H2反应生成CH4和H2O(g)的热化学方程式。
(2)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)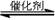 CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2)/n(CO2)]的变化曲线如下左图: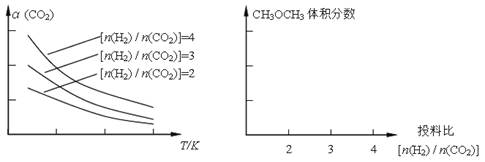
①在其他条件不变时,请在上图中画出平衡时CH3OCH3的体积分数随投料比[n(H2)/n(CO2)]变化的曲线图。
②某温度下,将2.0 mol CO2(g)和6.0 mol H2(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如下图所示,关于温度和压强的关系判断正确的是。
| A.P3>P2,T3>T2 | B.P1>P3,T1>T3 |
| C.P2>P4,T4>T2 | D.P1>P4,T2>T3 |
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的CO和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g)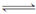 H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
| 温度/℃ |
400 |
500 |
800 |
| 平衡常数K |
9.94 |
9 |
1 |
该反应的平衡常数的表达式为:
该反应的正反应方向是反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的浓度均为0.020 mol·L-1,在该条件下CO的平衡转化率为。
(Ⅰ)短周期元素X、Y、Z、W原子序数依次增大,X氢化物的水溶液显碱性;Y在元素周期表中所处的周期序数与族序数相等;Z单质是将太阳能转化为电能的常用材料;W是重要的“成盐元素”,主要以钠盐的形式存在于海水中,请回答:
(1)X在元素周期表中的位置是;Y氢化物的电子式。
(2)X氢化物的水溶液与W氢化物的水溶液混合后恰好反应时,溶液呈。(填“酸性”、“碱性”或“中性”),用离子方程式表示其原因是。
(3)Y-AgO电池是应用广泛的鱼雷电池,其原理如图所示,该电池的负极反应式。
(4)由Z和W组成的化合物遇水立即水解产生两种酸,写出此反应的化学方程式。
(Ⅱ)A、B、C分别是由H、C、O、N、Na、Cu六种元素中的两种或多种元素组成的化合物。现对A、B、C三种化合物分别做以下实验:
A是一种蓝色固体,B是无色晶体,其式量为68,C是白色固体,分别取A、B、C三种物质少量于三支试管中,加适量水溶解,发现A不溶于水,B、C都能溶于水,并且用pH试纸测定,B与C的水溶液都显碱性。
(1)取A物质少量于一支试管中,后加适量稀盐酸溶解,并用酒精灯微热,发现固体溶解时,伴有气泡产生。将56.8gA隔绝空气加热分解生成40g黑色固体X、无色酸性气体Y(标准状况下,密度为1.96g/L)和水,生成的Y折合成标准状况下的体积为6.72L,则A的化学式为。
(2)取B的水溶液2ml与新制Cu(OH)2混合加热,发现能出现砖红色沉淀,则物质B为。
(3)取16.8gC固体加强热,将生成的气体依次通过经称量过的装CaCl2固体的干燥管和装足量Ba(OH)2水溶液的洗气瓶,后经再次称量发现干燥管增重1.8g,洗气瓶增重4.4g。写出C物质加入水后的溶液显碱性的原因。(用离子方程式和必要文字解释)
(14分) 2013年10月9日,2013年诺贝尔化学奖在瑞典揭晓,犹太裔美国理论化学家马丁·卡普拉斯、美国斯坦福大学生物物理学家迈克尔·莱维特和南加州大学化学家亚利耶·瓦谢尔因给复杂化学体系设计了多尺度模型而分享奖项。三位科学家的研究成果已经应用于废气净化及植物的光合作用的研究中,并可用于优化汽车催化剂、药物和太阳能电池的设计。
汽车尾气净化的主要原理为:2NO(g) + 2CO(g) 2CO2(g)+ N2(g) △H<0
2CO2(g)+ N2(g) △H<0
(1)同一条件下该反应正反应的平衡常数为K1,逆反应的表达式平衡常数为K2,K1与K2的关系式。
(2)若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是(填代号)。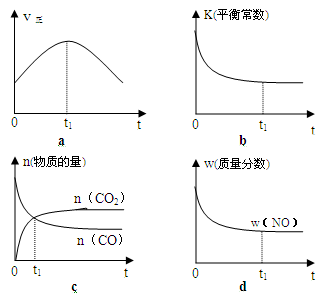
(3)在体积为10L的密闭容器中,加入一定量的CO2和H2,在900℃时发生吸热反应并记录前5min各物质的浓度,第6min改变了条件。各物质的浓度变化如下表;
| 时间/min |
CO2(mol/L) |
H2(mol/L) |
CO(mol/L) |
H2O(mol/L) |
| 0 |
0.2000 |
0.3000 |
0 |
0 |
| 2 |
0.1740 |
0.2740 |
0.0260 |
0.0260 |
| 5 |
0.0727 |
0.1727 |
0.1273 |
0.1273 |
| 6 |
0.0350 |
0.1350 |
0.1650 |
①前2min,用CO表示的该化学反应的速率为;
②第5—6min,平衡移动的可能原因是;
(4)直接排放煤燃烧产生的烟气会引起严重的环境问题。煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867 kJ/mol
2NO2(g) N2O4(g)△H=-56.9 kJ/mol
N2O4(g)△H=-56.9 kJ/mol
H2O(g) = H2O(l) △H=-44.0 kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式:。
(5)在一定条件下,可以用NH3处理NOx。已知NO与NH3发生反应生成N2和H2O,现有NO和NH3的混合物1mol,充分反应后得到的还原产物比氧化产物多1.4 g,则原反应混合物中NO的物质的量可能是_____________。
(6)在一定条件下,也可以用H2可以处理CO合成甲醇和二甲醚(CH3OCH3)及许多烃类物质。当两者以物质的量1:1催化反应,其原子利用率达100%,合成的物质可能是。
a.汽油b.甲醇c.甲醛d.乙酸