芳香族化合物A只有两个对位取代基,在一定条件下有如下图所示转化关系。其中,1 mol C与Na完全反应生成1 mol H2,若1 mol C与NaHCO3完全反应,也产生1 mol气体,E可以使溴的四氯化碳溶液褪色。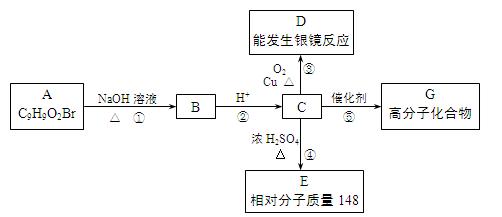
(1)D分子中的含氧官能团名称是 ,A的结构简式是 。
(2)反应④的基本类型是 反应,反应⑤的化学方程式是
。
(3)与C取代基位置相同,既能与FeCl3溶液显色、又能发生水解反应的同分异构体结构简式为: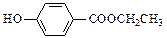 、
、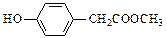 、
、
。
(4)现有C和 E的混合物n mol,在空气中完全燃烧消耗O2 L(标准状况),若生成CO2 a L(标准状况)、H2O b g,则C、E混合物中含E的物质的量的计算式为: 。
E的混合物n mol,在空气中完全燃烧消耗O2 L(标准状况),若生成CO2 a L(标准状况)、H2O b g,则C、E混合物中含E的物质的量的计算式为: 。
对金属制品进行抗腐蚀处理,可延长其使用寿命。
(1)以下为铝材表面处理的一种方法: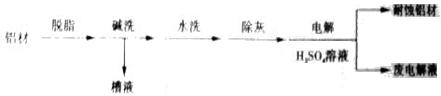
①碱洗的目的是除去铝材表面的自然氧化膜,碱洗时常有气泡冒出,原因是______(用离子方程式表示)。为将碱洗槽液中铝以沉淀形式回收,最好向槽液中加入下列试剂中的_______________。
a.NH3 b.CO2 c.NaOH d.HNO3
②以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极电极反应为_______________。取少量废电解液,加入NaHCO3,溶液后产生气泡和白色沉淀,产生沉淀的原因(用离子方程式表示)___________________________。
(2)利用如图装置,可以模拟铁的电化学防护。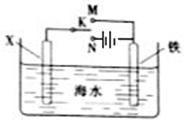
若X为碳棒,为减缓铁的腐蚀,开关K应置于______处。若X为锌,开关K置于M处,该电化学防护法称为_______。
一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO): CO(g)+2H2(g) CH3OH(g)
CH3OH(g)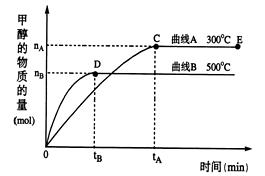
根据题意完成下列各题:
(1)合成甲醇反应中,其反应热△H0(填“>”“<”“=”)
(2)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2下列有关该体系的说法正确的是
a.氢气的浓度减少
b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加
d.重新平衡时n(H2)/n(CH3OH)增大
(3)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是:(用化学方程式表示)。
常温下将0.010molCH3COONa和0.004molHCl溶于水,配制成0.5L混合溶液,判断:
(1)溶液中有两种微粒的物质的量之和一定等于0.010mol,它们是和;
(2)溶液中n(CH3COO-) + n(OH-) - n(H+) = _____________mol。
Ⅰ、钨是我国丰产元素,是熔点最高的金属 , 广泛用于拉制灯泡的灯丝 , 有“光明使者”的美誉。钨在自然界主要以钨 (+6价) 酸盐的形式存在。有开采价值的钨矿石是白钨矿和黑钨矿。白钨矿的主要成分是钨酸钙 (CaWO4);黑钨矿的主要成分是铁和锰的钨酸盐,化学式常写成(Fe,Mn)WO4,钨酸(H2WO4)酸性很弱,难溶于水。黑钨矿传统冶炼工艺的第一阶段是碱熔法: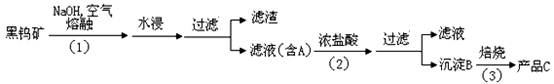
其中 A、B、C 都是钨的化合物。回答:
(1)74W在周期表的位置是第周期。
(2) 写出上述流程中B 、C 的化学式:B____________; C_____________
(3) 钨冶炼工艺的第二阶段则是用碳、氢等还原剂把氧化钨还原为金属钨。对钨的纯度要求不高时 , 可用碳作还原剂。写出用碳还原氧化钨制取金属钨的化学方程式:______________________________________________________________;
(4) 仲钨酸的阱盐在热分解时会发生内在氧化还原反应 ,我国钨化学研究的奠基人顾冀东先生采用这一反应制得了蓝色的、非整比的钨氧化物 WO3-x。这种蓝色氧化钨具有比表面大、易还原的优点 , 在制钨粉时温度容易控制 ,目前冶炼拉制钨丝的金属钨都用蓝色氧化钨为原料。经分析 , 得知蓝色氧化钨中钨的质量分数为 0.7985,X=0.1。一般认为,蓝色氧化钨的颜色和非整比暗示了在化合物中存在五价和六价两种价态的钨。则蓝色氧化钨中这两种价态的钨原子数比为________:________.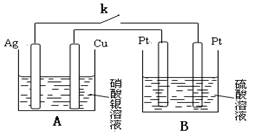
Ⅱ、如上图所示,当关闭电键k一段时间,发现Ag棒与 Cu棒质量差为28g时,则装置B产生气体的总质量为g(电解质溶液足量)。
现有A、B、C、D、E五种可溶强电解质,它们在水中可电离产生下列离子(各种离子不重复)。
| 阳离子 |
H+、Na+、Al3+、Ag+、Ba2+ |
| 阴离子 |
OH—、Cl—、CO32—、NO3—、SO42— |
已知:①A、B两溶液呈碱性;C、D、E溶液呈酸性。
②向E溶液中逐滴滴加B溶液至过量,沉淀量先增加后减少但不消失。
③D溶液与另外四种溶液反应都能产生沉淀。
试回答下列问题:
(1)A溶液呈碱性的原因是。
(2)写出E溶液与过量的B溶液反应的离子方程式。
(3)已知:NaOH(aq)+HNO3(aq)=NaNO3(aq)+H2O(1);△H=" —a" kJ·mol-1。
请写出相同条件下B与C的稀溶液反应的热化学方程式。
(4)若25°时C、E溶液pH=4,则E溶液中水电离出的氢离子浓度是C溶液中水电离出的氢离子浓度倍。
(5)将C溶液逐滴加入等体积、等物质的量的浓度的A溶液中,反应后溶液中一价离子(+1或一1)浓度由大到小的顺序为:。