(1)常温时,将浓度为m mol· L-1的CH3COOH溶液和n mol·L-1NaOH溶液等体积混合,混合后溶液的pH=7,m与n的大小关系是m n(填“>”、“<”或“=”,下同);若将PH=2的CH3COOH溶液和PH=12的NaOH溶液等体积混合,混合溶液的PH 7
(2)消防用的泡沫灭火器内装的药品是硫酸铝溶液和碳酸氢钠溶液,用离子方程式表示二者混合时发生的反应
(3)常温下某强酸溶液pH=a,强碱溶液pH=b,已知a+b=12,酸碱溶液混合pH=7,则酸溶液体积V1和碱溶液体积V2的关系为
(4)常温时KSP[Cu(OH)2]= 2.2×10-20,将Cu(OH)2溶于2.2mol/LCuCl2溶液中形成平衡,溶解平衡方程式为 ,溶液的PH为
(5)物质的量浓度相同的下列溶液①(NH4)2CO3 ②(NH4)2SO4 ③NH4HCO3 ④NH4HSO4 ⑤NH4Cl
⑥NH3·H2O。c(NH4+)由小到大的排列顺序是 (填序号)
将一摩尔质量为M g/mol的物质Wg,完全溶解制成VmL饱和溶液,若此溶液的密度为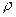 g/mL,则该物质在此温度下的溶解度是___________g,溶质的质量分数是_____________
g/mL,则该物质在此温度下的溶解度是___________g,溶质的质量分数是_____________
完全中和9.8g三元含氧酸酸H3AO4,消耗氢氧化钠12g,此三元酸物质的量是________,相对分子质量是_______.已知该酸是弱酸,请用其实际化学式分三步写出电离方程式。
某化学课外活动小组将氯化钠固体中混有的硫酸钠、碳酸氢铵杂质除去并得到氯化钠溶液,设计了如下方案: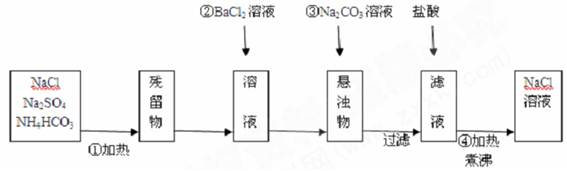
⑴操作①的目的是。
⑵操作②是否可改为加硝酸钡溶液?为什么?
___________;____________________________________________________________。
⑶操作③的目的是。
把18.0mol·L-1的浓硫酸稀释成2.00mol·L-1的稀硫酸100ml,实验操作如下,请填写有关的空格:
(1)将配好的稀硫酸倒入试剂瓶中,贴好标签;
(2)盖好容量瓶塞,反复颠倒,摇匀;
(3)用量筒量取ml的18.0mol·L-1的浓硫酸;
(4)将浓硫酸沿烧杯内壁慢慢注入盛有适量水的烧杯中,并不断搅拌;
(5)用少量蒸馏水洗涤烧杯2-3次,并将洗涤液也全部转移到容量瓶中;
(6)将已冷却至室温的硫酸溶液沿玻璃棒注入ml的容量瓶中;
(7)改用胶头滴管逐滴加蒸馏水,使溶液凹面恰好与刻度相切;
(8)继续向容量瓶中加蒸馏水,直到液面接近刻度线cm处;;
上述操作的正确顺序为-_______________________________________;若从上述所配制的溶液中取出10 ml 加水稀释至200 ml ,其物质的量浓度为_______________
0.01mol某气体的质量为0.44g,该气体的摩尔质量为;在标准状况下,该气体的体积为_____________________L,该气体的密度是 ___________