原电池是化学对人类的一个重大贡献。
(1)某兴趣小组为研究原电池原理,设计如图所示装置。
①a和b不连接时,烧杯中发生的离子方程式是_____________,
②a和b用导线连接,Cu极为原电池____________极(填“正”或“负”),Zn极发生__________(填“氧化”或“还原”)反应。
③Zn片上发生的电极反应:________________,Cu片上发生的电极反应:________________。
(2)若a和b相连接,导线上转移0.2mol电子时,理论上Zn片质量减轻___________g。
(8分)填写下列空白:
(1)烃A与含氢量最高的烃B属于同系物。在光照下1体积A最多能与6体积氯气完全反应(同温同压),则A的结构式是。
(2)烃C的相对分子质量是72,C的一溴代物种数是它的同分异构体中最多的,C的名称是。
(3)芳香烃D分子中含56个电子,碳与氢元素质量比为12:1,其加聚反应的化学方程式为。
(4)分子式为C8H10的芳香烃,其苯环上的一氯代物有种。
(8分)按要求回答下列问题:
(1) 的名称为___________________________;
的名称为___________________________;
(2) 的名称为____________________________;
的名称为____________________________;
(3)2,4-二氯甲苯的结构简式为__________________________;
(4)某物质结构如图所示,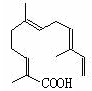
分子式为;
该物质可以与下列(填序号)发生反应。
| A.KMnO4酸性溶液 | B.氢气 | C.溴水 | D.NaOH溶液 |
(5) 中含有的官能团的名称为,。
中含有的官能团的名称为,。
(6)在戊烷的各种同分异构体中,核磁共振氢谱只有一个吸收峰的结构简式为_________________
(19分)金刚烷是一种重要的化工原料,工业上可通过下列途径制备:
请回答下列问题:
(1)环戊二烯分子中最多有________个原子共平面;
(2)金刚烷的分子式为________,其分子中的CH2基团有________个;
(3)下面是以环戊烷为原料制备环戊二烯的合成路线:
其中,反应①的产物名称是________,反应③的反应类型是________,
写出反应①的产物与NaOH溶液共热的化学方程式:_______________________;
反应的化学方程式:___________________________________________。
(4)已知烯烃能发生如下反应:

 RCHO+R′CHO
RCHO+R′CHO
请写出下列反应产物的结构简式: ___________________________________________;
___________________________________________;
(5)A是二聚环戊二烯的同分异构体,能使溴的四氯化碳溶液褪色,A经高锰酸钾酸性溶液加热氧化可以得到对苯二甲酸[提示:苯环上的烷基(—CH3,—CH2R,—CHR2)或烯基侧链经高锰酸钾酸性溶液氧化得羧基],写出A所有可能的结构简式(不考虑立体异构):______________________________。
现有四种有机化合物:
试回答:
(1)甲、乙、丁都含有的官能团的名称是________。
(2)1 mol甲、乙、丁分别与足量Na反应,生成H2最多的是________(填编号,下同)。
(3)互为同分异构体的是________。
(4)等物质的量的甲、乙、丙、丁充分燃烧,消耗氧最少的是________。
(5)丁与醋酸在催化剂作用下发生取代反应生成的酯有________种。
下列是八种环状的烃类物质:
(1)互为同系物的有________和________(填名称)。互为同分异构体的有________和________、________和________(填写名称,可以不填满,也可以再补充)。
(2)正四面体烷的二氯取代产物有________种;立方烷的二氯取代产物有________种;金刚烷的一氯取代产物有________种。
(3)写出与苯互为同系物且一氯代物只有两种的物质的结构简式(举一例)并用系统命名法命名:
___________________、_______________。