(I)研究CO2的利用对促进低碳社会的构建具有重要的意义。将CO2与焦炭作用生成
CO,CO可用于炼铁等。
(1)已知:Fe2O3(s) + 3C(石墨) =2Fe(s) + 3CO(g) △H 1 =+489 kJ/mol
C(石墨)+CO2 (g)=2CO(g) △H 2 = +172 kJ/mol
则Fe2O3(s) + 3CO(g) = 2Fe (s) + 3CO2(g) △H= 。
(2)利用燃烧反应可设计成CO/O2燃料电池(以H2SO4溶液为电解质溶液),写出该电池的正极反应式 。
(II)某学生设计了如图所示的装置(框内部分未画出),
在装置内起初发生的反应为Cu+H2SO4H2↑+CuSO4(未注明反应条件),试回答:
(1)该装置的名称是 (填“电解池”或“原电池”)。
(2)A、B中至少有一种是金属 (填名称),接电源的 (填“正极”或“负极”)。
(3)写出该装置中发生还原反应的电极反应方程式为 。
(4)若C溶液为100ml饱和食盐水,A 和B电极均为碳棒,该学生利用图示装置进行电解,写出该电解过程中的总反应的离子方程式 ,当放出标况下112ml氢气时,该溶液的pH= (室温下)。
(III)利用下图装置,可以模拟铁的电化学防护。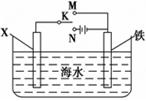
若X为铜,为减缓铁的腐蚀,开关K应置于 处。
若X为锌棒,开关K置于M处,该电化学防护法称为 。
目前,市场上经常用甲醇碱性燃料电池做为手机的电池,该电池的储电量可长达一个月,非常适合通话量比较高的人群,请写出该燃料电池的正极电极反应: 和负极电极反应: 。
(1)某校学生用中和滴定法测定某NaOH溶液的物质的量浓度。
①盛装0.2000 mol/L盐酸标准液应选用的滴定管是_________(填字母序号)。
②当接近滴定终点时,很少量的碱或酸就会引起溶液的 突变。
③有关数据记录如下:
| 实验编号 |
待测液体积(mL) |
所消耗盐酸标准液的体积(mL) |
|
| 滴定前 |
滴定后 |
||
| I |
20.00 |
0.50 |
20.70 |
| II |
20.00 |
6.00 |
26.00 |
| III |
20.00 |
1.40 |
21.20 |
根据数据计算NaOH溶液的物质的量浓度是______________mol/L。
④若只用蒸馏水冲洗锥形瓶,则测定结果_________(填“无影响”.“偏高”或“偏低”)。
(2)25℃,将一元酸HA溶液和NaOH的溶液等体积混合,两种溶液的浓度和混合后溶液的pH见下表:
| 实验编号 |
c(HA)/mol﹒L-1 |
c(NaOH)/mol﹒L-1 |
混合溶液的pH |
| I |
0.2 |
0.2 |
pH=a |
| II |
c1 |
0.2 |
pH=7 |
| III |
0.2 |
0.1 |
pH>7 |
| IV |
0.1 |
0.1 |
pH=9 |
请回答:
①不考虑其它组实验结果,单从I组实验情况分析,若a_____7(填“>”“<”或“=”),则HA为强酸。
②在II组实验的混合溶液中,c(A-)______ c(Na+)(填“>”“<”或“=”)。
③不考虑其它组实验结果,单从III组实验情况分析,HA是_____酸(填“强”或“弱”);用离子方程式表示混合溶液中存在的两种平衡:_________________,____________________。
④IV组实验的混合溶液中,由水电离出的c (OH-)=___________。
如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2 mol SO2和1 mol O2,乙中充入2 mol SO3和1 mol He,此时K停在0处。在一定条件下发生可逆反应:2SO2(g)+O2(g) 2SO3(g),反应达到平衡后,再恢复至原温度。回答下列问题:
2SO3(g),反应达到平衡后,再恢复至原温度。回答下列问题:
(1)达到平衡后隔板K是否可能处于0刻度_______(填“可能”或“不可能”)。若K最终停留在0刻度左侧a处,则a一定小于________。
(2)若平衡时,K最终停留在左侧刻度1处,则甲中SO3的物质的量为__ __mol,乙中SO3的转化率________50%(填“>”、“<”或“=”),活塞F最终停留在右侧刻度________处(填下列序号:①<6 ②>6 ③=6)。
(3)若一开始就将K、F固定,其他条件均不变,则平衡时,甲、乙中SO3的物质的量分数是甲________乙(填“>”、“<”或“=”);测得甲中SO2的转化率为w%,则乙中SO3的转化率等于________。
(4)平衡后将甲容器的混合气的1.0%通入足量Ba (NO3)2溶液,生成的BaSO4质量为________g。
在10 L的密闭容器中,进行如下化学反应:
CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
| T/℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
请回答:
(1)该反应为 (填“吸热”或“放热”)反应。
(2)该反应的化学平衡常数表达式为K = 。
(3)一定条件下,能说明该反应达到化学平衡状态的是 (填字母)。
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,将CO2和H2各0.10 mol充入该容器中,达到平衡后,测得 c(CO) =" 0.0080" mol﹒L-1 ,则CO2的转化率为 。
(5)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃。
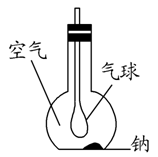
(1)用金属钠制取过氧化钠的化学方程式是 ,现象是 。
(2)已知用金属钠生成氧化钠,有多种方法:
①4Na+O2===2Na2O ②4Na+CO2===2Na2O+C
③2NaNO2+6Na===4Na2O+N2↑
在上述三种方法中最好的方法是 ,原因是 。
(3)如图所示装置,在平底烧瓶的底部有一块钠,平底烧瓶内是干燥的空气。过一段时间后可观察到 ,发生反应的化学方程式为 。