在10 L的密闭容器中,进行如下化学反应:
CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
| T/℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
请回答:
(1)该反应为 (填“吸热”或“放热”)反应。
(2)该反应的化学平衡常数表达式为K = 。
(3)一定条件下,能说明该反应达到化学平衡状态的是 (填字母)。
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,将CO2和H2各0.10 mol充入该容器中,达到平衡后,测得 c(CO) =" 0.0080" mol﹒L-1 ,则CO2的转化率为 。
(5)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃。
(原创)铜及其化合物在工农业生产中都有着广泛应用。
(1)火法炼铜首先要焙烧黄铜矿,其反应为:2CuFeS2+O2=Cu2S+2FeS+SO2、Cu2S+O2=2Cu+SO2。当有1molCu生成,则第一个反应中转移电子 mol。
(2)某种处理火法炼铜中SO2废气的工艺流程如下图所示。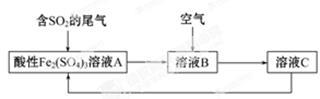
①溶液A中发生的反应为 。
②由流程图可推知Fe3+、O2、SO42-的氧化性由强到弱的顺序为 。
(3)已知反应:3Cu+2NO3-+xH+=3Cu2++2R+yH2O。则
①反应中的x= 。
②反应产物R的化学式为 。
③参加反应的Cu和消耗的HNO3物质的量之比为 。
下图是化学实验中常用的几种装置。
请回答下列问题: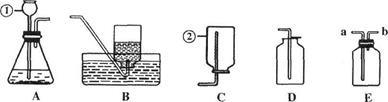
(1)指出有编号的仪器名称:① ,② 。
(2)利用上述A、D装置的组合可以制取的一种气体是 ,写出实验室制取该气体的化学反应方程式 。
(3)若用E装置收集该气体,则气体应从 (选“a”或“b”)导入;若用E装置干燥生成的气体,E中盛放的液体试剂是 。
(4)在实验室如使用碳酸钠与稀盐酸、选用A装置制二氧化碳,需要对A装置进行的改进是 。
如图所示:A、B、C、D是初中化学中常见的不同类别的物质,已知A、B是空气中的两种气体,“ ”表示两种物质在一定条件下可相互转变。依据给出的信息推断并回答下列问题:
”表示两种物质在一定条件下可相互转变。依据给出的信息推断并回答下列问题: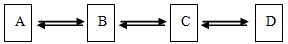
(1)B转化为A的过程叫 ;
(2)B物质的一种用途是 ;
(3)C物质所属的类别是 ;
(4)D转化为C的反应方程式是 。
如图是稀盐酸和氢氧化钠溶液反应过程中溶液酸碱度的变化情况。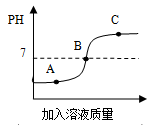
(1)该实验操作是将 滴加到另一种溶液中。
(2)A点时溶液中的溶质是 (填化学式)。
(3)右下图是反应中某时的微观图示,此时对应于上图中A、B、C中的哪一点? ;证明你的判断正确的实验操作方法是:向反应后的溶液中滴加 溶液。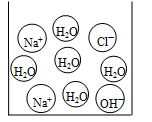
如下左图是甲、乙两种物质的溶解度曲线,右图所示两个烧杯中各盛有20℃时两种物质的饱和溶液。请你通过分析,回答下列问题:

(1)下列方法中能使甲物质的溶解度增大的是
| A.溶解时搅拌 | B.升高温度 | C.降低温度 | D.增加水的质量 |
(2)在80℃时,将55克甲物质放到50克水中,形成溶液的质量是 克。
(3)不改变溶质质量分数使接近饱和的乙的不饱和溶液变为饱和溶液的方法是 。
(4)当温度由20℃升高到60℃时(不考虑水分蒸发),B烧杯中固体质量增多,则B烧杯溶液中的溶质是 (填“甲”或“乙”)。
(5)将80℃的甲、乙饱和溶液降温到40℃,得到的溶液中溶质的质量分数大小关系是甲 乙(填“>”、“=”或“<”)。
(6)甲中含有少量乙时,提纯甲的方法是 。