I。锂——空气电池能够提供相当于普通锂离子电池10倍的能量,因此它是很有前途的电池技术。下图是锂——空气电池放电时的工作示意图。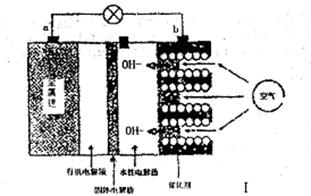
(1)图1中电极a是 极。
(2)电池中间的固体电解质(含阳离子交换膜)还能阻止H2O、N2、O2等物质的通过防止Li和这些物质反应。Li和水在常温下发生反应的化学方程式为 。
II.某些锂电池广泛应用于手机、数码相机及便携式电脑中。此种锂电池的负极通常由金属锂构成,正极由二氯亚砜(SOCl2)和碳材料构成。总反应为:4Li+2SOCl2=4LiCl+S+SO2↑,此种锂电池是一次电池,在放电时有气体产生。以下说法中正确的是 。
| A.放电时电池内部Li+向负极移动[ |
| B.放电过程中,电池负极发生氧化反应 |
| C.放电时每移动2mol电子,有1molS被还原 |
D.放电时电池正极反应为 :3SOCl2+4e-=SO2+S+4Cl- :3SOCl2+4e-=SO2+S+4Cl- |
III.锂电池回收具有重要意义,重点回收的正极材料,其主要成分为钴酸锂(LiCoO2)、铝箔等。
某回收工艺流程如下: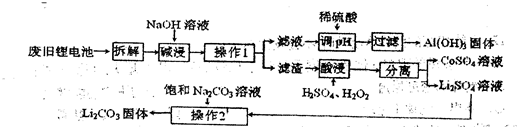
(1)废旧电池残留有单质锂,拆解时需隔绝空气,是因为锂易与空气中的  反应。
反应。
(2)酸浸时钴酸锂发生反应的化学方程式为 。若用盐酸代替H2SO4、H2O2混合液也能达到酸浸目的,但不利之处是 。
(3)Li2CO3在水中的溶解度随温度升高而减小,操作2的步骤是:加热浓缩析出晶体、 、洗涤、干燥。
已知a、I、e为三种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下:
| 粒子代码 |
a |
I |
e |
| 原子核数 |
单核 |
四核 |
双核 |
| 粒子的电荷数 |
一个单位正电荷 |
0 |
一个单位负电荷 |
物质A由a、e构成,B、C、D、K都是单质,反应①~⑤都是用于工业生产的反应,各有关物质之间的相互反应转化关系如下图所示:
请填写下列空白:
(1)写出下列物质的化学式:B,J。
(2)写出下列反应的离子方程式:
①H+E(溶液)→M
。
②I溶于G
。
(3)在通常状况下,若1 g C气体在B气体
中燃烧生成H气体时放出92.3 kJ热量,则2 mol H气体完全分解生成C气体和B气体的热化学方程式为。
下图中A~J分别代表相关反应中的一种物质,已知A分解得到相等物质的量的B、C、D,图中有部分生成物未写出。
请填写以下空白:
⑴B的电子式______________,D分子的空间构型_________________。
⑵写出反应①、②的化学反应方程式:
①_____________________________________________________________;
②_____________________________________________________________。
⑶写出反应③的离子方程式:____________________________________________。
随着经济的不断发展,人们对环境问题也越来越关注。
(1)室内空气污染问题得到越来越多的关注,下列物质中也属于室内挥发性有机污染物的是___________________。(填字母)
a.苯 b.甲烷 c.醋酸 d.乙烯
(2)下列措施中,有利于降低室内污染物浓度的是__________。(填字母)
a.勤开窗通风 b.日常生活中利用天然气替代煤作燃料
c.使用“绿色环保”装饰材料d.室内放一些活性碳
(3)“温室效应”是全球关注的环境问题之一。CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决温室效应的有效途径。将CO2转化成有机物可有效实现碳循环。CO2转化成有机物的例子很多,如:
a.6CO2 + 6H2O C6H12O6+6O2b.CO2 + 3H2
C6H12O6+6O2b.CO2 + 3H2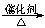 CH3OH +H2O
CH3OH +H2O
c.CO2 + CH4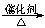 CH3COOHd.2CO2 + 6H2
CH3COOHd.2CO2 + 6H2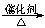 CH2==CH2 + 4H2O
CH2==CH2 + 4H2O
以上反应中,最节能的是 ,原子利用率(原子利用率=期望产物的总质量与生成物的总质量之比)最高的是 。
(4)“汽车尾气污染”已倍受世人关注。以辛烷(C8H8)代表汽油的成分,要使辛烷正好完全燃烧,则辛烷气与空气(空气中O2占1/5体积)的体积比(相同条件下)为 (保留三位小数)。
下图是CH2=CH—CH=CH2合成D(OHC—CH=CH—CHO)的流程。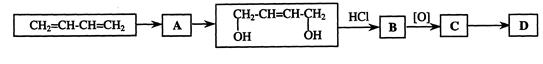
回答下列问题:
(1)若A为溴代物写出其结构简式 。
(2)写出B C反应的化学方程式 。
C反应的化学方程式 。
(3)写出C D的反应类型 。
D的反应类型 。
(4)已知CH2=CH—CH=CH2+CH2=CH2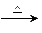
 ,请写出CH2=CH—CH=CH2两分子加成后的产物 。
,请写出CH2=CH—CH=CH2两分子加成后的产物 。
某含苯环的化合物A,其相对分子质量为104,碳的质量分数为92.3%。
(1)A的分子式为 。
(2)A与溴的四氯化碳溶液反应的化学方程式为 ,反应类型是 ;
(3)已知: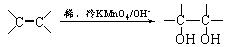 。请写出A与稀、冷的KMnO4溶液在碱性条件下反应所得的产物 ;
。请写出A与稀、冷的KMnO4溶液在碱性条件下反应所得的产物 ;
(4)一定条件下,A与氢气反应,得到的化合物中碳的质量分数为85.7%,写出此化合物的结构简式 ;
(5)在一定条件下,由A聚合得到的高分子化合物的结构简式为 。