草酸(乙二酸)可作还原剂和沉淀剂,用于金属除锈、织物漂白和稀土生产。一种制备草酸(含2个结晶水)的工艺流程如图:回答下列问题: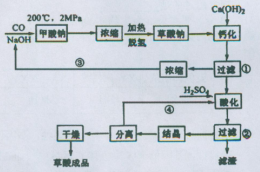
(1)CO和NaOH在一定条件下合成甲酸钠,甲酸钠加热脱氢的化学反应方程式分别为:____、____ 。
(2)该制备工艺中有两次过滤操作,过滤操作①的滤液是 ,滤渣是____ ;过滤操作②的滤液是 和 ,滤渣是____ 。
(3)工艺过程中③和④的目的是____ 。
(4)有人建议甲酸钠脱氢后直接用硫酸酸化制备草酸。该方案的缺点是产品不纯,其中含有的杂质主要是___ 。
(5)结晶水合草酸成品的纯度用高锰酸钾法测定。
称量草酸成品0.250 g溶于水,用0.0500 mol·L-1的酸性KMn04溶液滴定,至浅粉红色不消褪,消耗KMn04溶液15.00 mL,反应的离子方程式为____ ;
列式计算该成品的纯度 。
(8分)将2 mol H2O和2 mol CO置于1 L容器中,在一定条件下加热至高温,发生如下可逆反应:
2H2O(g) 2H2(g)+O2(g) 2CO(g)+O2(g)
2H2(g)+O2(g) 2CO(g)+O2(g) 2CO2(g)
2CO2(g)
(1)当上述系统达到平衡时,欲求其混合气体的平衡组成,则至少还需要知道两种气体的平衡浓度,但这两种气体不能同时是________和________,或________和________。
(2)若平衡时O2和CO2的物质的量分别为n(O2)平=a mol,n(CO2)平=b mol。试求n(H2O)平=________。(用含a、b的代数式表示)
(8分)在2 L密闭容器内,800℃时反应2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)/mol |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)写出该反应的平衡常数表达式:K=________。
已知:K300℃>K350℃,则该反应是________热反应。
(2)如图中表示NO2的变化的曲线是________。用O2表示从0~2 s内该反应的平均速率v=________________________________________________________________________。
(3)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
硼酸在玻璃制造和医药领域应用广泛。
(1)元素周期表中存在“对角线”规则,硼与硅的某些化学性质类似,写出硼酸(H3BO3)加热至300℃时分解得到相应氧化物的化学方程式:。
(2)硼酸(H3BO3)溶液中存在如下反应:
H3BO3(aq)+H2O(l)  [B(OH)4] –(aq)+H+(aq) K=5.7×10–10(298K)
[B(OH)4] –(aq)+H+(aq) K=5.7×10–10(298K)
①实验中不慎将NaOH沾到皮肤时,用大量水洗后要涂上硼酸溶液。写出硼酸与NaOH反应的离子方程式。
②计算25℃时0.7mol·L–1硼酸溶液中H+的浓度。(写出计算过程,计算结果保留小数后一位)
(3)已知298K时:
| 化学式 |
碳酸 |
醋酸 |
| 电离常数 |
K1=4.4×10—7 K2=4.7×10—11 |
K=1.75×10—5 |
下列说法正确的是。
| A.碳酸钠溶液滴入硼酸中能观察到有气泡产生 |
| B.碳酸钠溶液滴入醋酸中能观察到有气泡产生 |
| C.等物质的量浓度的碳酸溶液和硼酸溶液比较,pH:前者>后者 |
| D.等物质的量浓度的碳酸氢钠溶液和醋酸钠溶液比较,pH:前者>后者 |
某有机物A在酸性溶液中加热可发生如下反应:
请回答下列问题:
(1)下列关于该有机物A说法错误的是。
①可发生银镜反应②1molA在一定条件下与氢气反应,最多可消耗5molH2
③能发生消去反应④1molA与烧碱溶液反应,最多可消耗4mol NaOH
(2)有机物B的化学式(分子式)为;B在铂的催化下,与足量氢气发生加
成反应生成X,则X的结构简式为。
(3)有机物R的结构简式为; R与足量的醋酸发生反应(填基本反应类型)的化学方程式为:
。
把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16g白色沉淀,再向所得悬浊液中逐滴加入1.00mol/L HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示。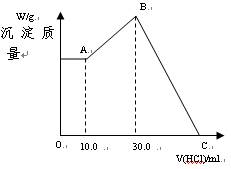
试回答:
(1)A点的沉淀物的化学式为,理由。
(2)写出A点到B点发生反应的离子方程式。
(3)原混合物中MgCl2的质量是,AlCl3的质量是,NaOH的质量是。
(4)C点溶液的体积为mL。